pH拾零
时间:2016-02-02 19:49 来源:未知 作者:潘祥泰 点击: 次 所属专题: ph值 ph计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、pH与酸碱性
1.溶液酸碱性的强弱由pH决定,与温度、溶质无关。如:pH均为2的硫酸溶液与醋酸溶液酸度相同。
2.pH等于7的溶液不一定呈中性。(“pH=7为中性”习惯上指常温时)
二、pH的计算
1.计算时先确定溶液的酸碱性,计算顺序为:酸性→c(H+)→pH;碱性→c(OH-)→c(H+)→pH。
例1 pH=8的Ba(OH)2与pH=10的NaOH溶液等体积混合后(稀溶液混合时体积变化可忽略),问混合后溶液的pH为多少?
![]()
=5×10-9(mol/L)
pH= -lgc(H+)=-lg5×10-9=8.3
正解 由题知溶液呈碱性。故
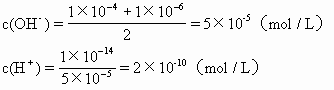
pH= -lgc(H+)=-lg2×10-10=9.7
2.pH与水的电离:弄清H+和OH-主要是水电离产生还是酸碱电离产生是计算c(H+)、c(OH-)、pH的前提。
例2 已知某温度下重水D2O的Kw=1.6×10-15,问含0.01 mol DCl的重水溶液1L,pD为多少?含0.01 molNaOD的重水溶液1L,pD又为多少?
解析 DCl溶液中D+主要来源于DCl的电离,因此c(D+)=c(DCl)=0.01 mol/L,pD= -lgc(D+)=-lg0.01=2
NaOD溶液中OD-主要由NaOD电离产生,D+由水电离产生,故
c(OD-)=c(NaOD)=0.01 mol/L
![]()
pD=-lgc(D+)=-lg1.6×10-13=12.8
例3 315K时水的离子积 Kw为 4.01×10-14,问pH=7时溶液呈何性?
解析 溶液呈中性时:
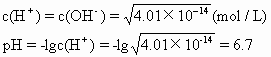
因为7>6.7,则pH=7时溶液呈碱性。
3.pH与酸的浓度:pH由c(H+)即酸度决定,c(H+)可大于酸的浓度(如二元强酸H2SO4),也可等于酸的浓度(如一元强酸HCl),还可小于酸的浓度(如弱酸)。
例4 (1995年高考第21题)c1、c2,α1、α2,pH1、pH2分别表示两种一元弱酸的物质的量浓度、电离度和溶液的pH。如果已知pH1<pH2,且α1>α2,则c1和c2的关系为 [ ]。
A.c1>c2 B.c1<c2 C.c1=c2 D.无法确定
解析 由pH1<pH2可知:c(H+)1>c(H+)2,对一元弱酸:c(H+)=cα(忽略水的电离)。故c1α1>c2α2,又因为α1>α2,所以c1、c2的大小关系无法确定,答案为D。
三、溶液呈中性的情况
1.c(H+)=c(OH-);
2.一元酸HA与一元碱ROH的混合溶液中:c(R+)=c(A-);
3.酸碱指示剂确定。
四、测pH
1.用pH计可准确测定;
2.用酸碱指示剂估计pH的范围;
3.用pH试纸和标准比色卡粗略测定时,pH不能带小数,试纸事先不能润湿(与石蕊试纸,淀粉碘化钾试纸,醋酸铅试纸等检验气体时区分)。
五、pH的变化
1.放置 下列溶液放置后 pH将如何变化?氯水、氢硫酸、浓硫酸、浓盐酸、氢氧化钠溶液、亚硫酸钠溶液等。
2.反应 下列反应前后溶液pH的变化如何?①SO2气体分别通入氯水、氢硫酸溶液;②H2S气体分别通入氯水、硫酸铜溶液;③CO2气体通入氢氧化钠溶液。
3.电解 下列电解质的水溶液在电解过程中pH如何变化?HCl、H2SO4、NaOH、CuCl2、Na2SO4、CuSO4、NaCl等。
4.稀释 ①强酸溶液稀释10倍 pH增大 1,强碱溶液稀释10倍pH则减小1;②酸性或碱性溶液无限稀释后pH接近7;③强酸、弱酸稀释相同倍数时,pH变化的大小不同。
六、pH的应用
1.调节pH,可指定溶液中某种离子沉淀或溶解。如:除去酸性CuCl2溶液中的Fe3+,可加入CuO并使溶液pH为3~4,Fe3+即转化为Fe(OH)3,过滤除去;又如用盐酸滴定含杂质Na2CO3的NaOH时,加入足量的BaCl2掩蔽Na2CO3,再用酚酞作指示剂进行滴定即可。
2.粗盐NaCl(含Ca2+、Mg2+、SO42-等)提纯时,依次加入过量的NaOH、BaCl2、Na2CO3沉淀Mg2+、SO42-、Ca2+后,再用盐酸除去溶液中过量的CO32-和OH-时,可采用调节pH控制盐酸的用量。
3.酸碱中和滴定终点时指示剂的选择。如测定NaOH、Na2CO3混合物组成时,选择酚酞、甲基橙作指示剂,分两阶段进行滴定。

- 全部评论(0)
