水解平衡常数的计算
时间:2019-11-24 16:15 来源: 作者:王金玉 点击:次 所属专题: 盐类水解 水解平衡常数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一.醋酸钠溶液的水解(强碱弱酸盐水解)
Ac-+H2O⇋HAc+OH-
平衡常数:
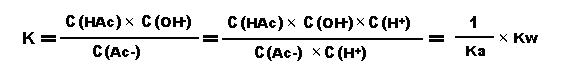
(Kw是水的离子积,Ka是醋酸的电离常数)
二.氯化铵溶液的水解(强酸弱碱盐水解)
NH4++H2O ⇋ NH3·H2O + H+
平衡常数:
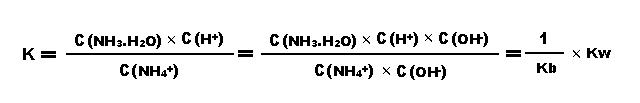
(Kw是水的离子积,Kb是氨水的电离常数)
三.醋酸铵溶液的水解(弱酸弱碱盐水解)
Ac- + H2O ⇋ HAc + OH- NH4+ + H2O ⇋ NH3·H2O + H+
由于生成的H+和OH-会结合生成水,所以促进醋酸铵的水解,两式相加得醋酸铵总的水解方程:Ac- + NH4+ + H2O ⇋ HAc + NH3·H2O
平衡常数: (Kw是水的离子积,Ka是醋酸的电离常数,Kb是氨水的电离常数)
四.对于氯化铁溶液的水解(无电离常数的强酸弱碱盐水解)
Fe3++ 3H2O ⇋ Fe(OH)3 + 3 H+这个平衡的常数表达式为:K=c3(H+)/c(Fe3+),液态水和固体氢氧化铁的浓度不变看待。
当加入浓度更大的铁离子,意思就是提高了铁离子浓度,氢离子浓度基本不变(溶液体积的变化忽略不计)为了使K不变(温度不变,平衡常数不变),水解平衡必须往右移动,氢离子浓度增加,酸性增强。
当加水稀释时,则氢离子和铁离子浓度基本上是同倍减少,则为了使K不变,平衡必须往右移动,氢离子浓度和铁离子浓度都减少,酸性减弱。
由于存在氢氧化铁的沉淀溶解平衡和水的电离平衡,所以存在以下关系:所以铁离子水解的平衡常数: (Kw是水的离子积,Ksp是溶度积常数)
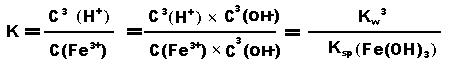
若为氯化铜Cu2++ 2H2O ⇋ Cu(OH)2 + 2H+,则平衡常数:
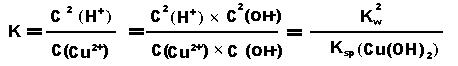
(责任编辑:)

说点什么吧
- 全部评论(0)
(2627346054) 评论 水解平衡常数的计算:是的,是水解平衡常数
(284330026) 评论 水解平衡常数的计算:我想知道,为什么水解平衡常数要用K2计算
(2240417679) 评论 水解平衡常数的计算:Kh是盐的水解平衡常数
(1901847727) 评论 水解平衡常数的计算:Kh是水解常数符号吗
(1901847727) 评论 水解平衡常数的计算:Kh是水解常数符号吗
(3049238106) 评论 水解平衡常数的计算:最后那个氯化铜k的第二步的分母的氢氧根浓度应该是平方,(顺便说一下,刚才评论多点
(3049238106) 评论 水解平衡常数的计算:氯化铜那个方程式应该是2H+
还没有评论,快来抢沙发吧!
