怎样讲清卤化氢的稳定性
时间:2016-03-20 16:05 来源:未知 作者:潘祥泰 点击: 次 所属专题: 稳定性 卤化氢
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
解答在中学化学教学中,讲淸卤化氢的 稳定性,对于掌握卤素单质的氧化性和卤素阴 离子的还原性是有重要意义的。通过卤化氢对热稳定性和氢卤键的牢固性的分析,以及它们对氧化剂的还原性实验,可以使学生对卤化氢 的稳定性有更深刻的理解。
卤化氬对热的稳定性对热的稳定性 是化合物的重要性质之一,它的标志之一是生 成热。所谓生成热是生成1摩尔化合物时的热 效应。下表是卤化氢的生成热数据:
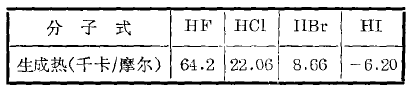
从上表可以看出,生成热的数值越大,化合物越稳定;反之,生成热数值越小,化合物越不稳定;其次,也可用分解温度和在某给定温度时的分解百分率来判断卤化氢的稳定性。
据实验测定,在300°C时HI开始分解,而 HCl和HF必须加热到100°C时才稍有分解。 在1000°C时卤化氢的分解百分率如下:
分子式 | HC1 | HBr | HI |
分解百分率 | 0.014% | 0.5% | 33% |
从以上数据可以看出,卤化氢对热的稳定 性,随着卤素原子半径的增大而降低,它们的顺序是 HF>HCl>HBr>HI。
1. 氢卤键的牢固性
在一个大气压和 25°C时,将1摩尔卤化氢分子的氢卤键(H-X) 断裂,使它成为气态的氢原子和卤素原子所需 的能量就是卤化氢的离解能(单位是千卡/摩 尔)。由于卤化氢分子是双原子分子,所以它的离解能也就是它的键能E,卤化氢的键能如下 表:
分子式 | HF | HCI | HBr | HI |
键能E (千卡/摩尔) | 136 | 103 | 87 | 71 |
一般地说,键能越大,化学键越牢固,含有这种化学键的分子也就越稳定。从上表的数据 来看,HF的键能最大,H一F键最牢固,所以 HF分子最稳定。HI的键能最小,不牢固,所以HI分子最不稳定。HCl和HBr的键能大小和分子稳定性介于HF和HI之间,因此卤化 氢分子的稳定性顺序是HF>HCl>HBr>HI。
2. 卤化氢的还原性
卤化氢的还原性是踉它的稳定性密切联系的。稳定性越大,还原性越弱;稳定性越小,还原性越强,我们可用下列实验来证明:
在三只试管里,分别盛有少量 的NaCl、NaBr和KI的晶体,然后在每只试管 里滴入6〜8滴浓硫酸。
实验结果表明:
第一只试管口有白雾产生。
第二只试管口有大量白雾; 片刻后,出现红棕色蒸气。
第三只试管中有紫 黑色物质,管口有腐蛋嗅味。
第一只试管产生 的HC1没有被氧化,说明还原性较弱;第二只 试管产生的HBr被浓H2SO4氧化为单质Br2, 出现红棕色蒸气,这表明HBr的还原性大于 HCl。第三只试管产生的HI立即被浓H2SO4氧化成单质碘,所以试管壁上出现紫黑色的碘, 同时浓H2SO4本身被还原成具有腐蛋味的气体。
这个实验说明了卤化氢的还原性是 按HCI、HBr, HI的顺序逐渐增强的。

- 全部评论(0)
