怎样理解有机物沸点变化的规律
时间:2012-05-19 20:39 来源:未知 作者:舒龙昌 点击: 次 所属专题: 沸点 有机物物理性质
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有机物的沸点高低变化是有规律可循的。液体沸点的高低决定于分子间引力的大小,分子间引力越大,使之沸腾就必须提供更多的能量,因此沸点就越高。分子间的引力称范德华力,它包括取向力、诱导力和色散力。除此之外还有一种力叫氢键,它的存在也对有机物的沸点有重要影响。
分子间引力的大小取决于分子结构,所以归根到底,有机物沸点的高低取决于分子本身的结构,其变化规律可以归纳为以下几个方面。
1.结构相似看分子量
对结构相似的有机物,其沸点高低主要由他子量的大小来决定。因为分子量越大,分子间的范德华力越大,沸点就越高。例如正烷烃系列:
| 名称 | 分子式 | 状态 | 沸点(℃) |
| 甲烷 | CH4 | 气 | —164 |
| 乙烷 | C2H6 | 气 | —88.6 |
| 丙烷 | C3H8 | 气 | —42.1 |
| 丁烷 | C4H10 | 气 | —0.5 |
| 戊烷 | C5H12 | 液 | 36.1 |
| 庚烷 | C7H16 | 液 | 68.9 |
| 辛烷 | C8H18 | 液 | 125.7 |
正烷烃是非极性分子,分子间主要存在色散力。正烷烃分子的分子量越大即含碳原子数越多,原子个数也就越多,色散力当然也就越大。因此,正烷烃的沸点随着碳原子数的增多而升高。
2.同类同分异构体看支链
在有机物的同分异构体中,分子中所含的支链越多,其沸点越低。如戊烷的三种同分异构体的沸点如下:
| 名称 | 正戊烷 | 异戊烷 | 新戊烷 |
| 结构 | CH3CH2CH2CH2CH3 | (CH3)2CHCH2CH3 | (CH3)4C |
| 沸点 | 36.1 | 27.9 | 9.5 |
分子中支链的增多,使分子间相互靠近受到阻碍,分子间接近程度或者说分子间接触面积减小。由于色散力只有近距离内方能有效地产生作用.因此随着分子中支链的增多,分子之间距离增大,必然表现出有机物沸点的降低。
3.分子量相同看分子极性
如果有机物分子是极性分子,由于极性分子具有偶极,而偶极是电性的。因此,极性分子之间除了具有色散力外,还具有偶极之间的静电引力。这样,极性分子之间的分子间力比非极性分子要大得多,所以使沸点升高。例如分子量相同的丁烷和丙酮:
| 分子量 | 沸点 | 结构(℃) | |
| 丙酮 | 58 | 56.2 | |
| 丁烷 | 58 | CH3CH2CH2CH3 | —0.5 |
丙酮分子中含有羰基![]() ,由于碳氧电负性不同,碳原子上带有部分正电荷,氧原子上带有部分负电荷。当这样的极性分子相互接近时,势必产生较大的分子间力,从而表现出沸点值较大程度地升高。
,由于碳氧电负性不同,碳原子上带有部分正电荷,氧原子上带有部分负电荷。当这样的极性分子相互接近时,势必产生较大的分子间力,从而表现出沸点值较大程度地升高。
4.不要忘记看氢键
如果有机物分子间能形成氢键,在液态时,分子间就能通过氢键结合形成较大的缔合体。这样的液体沸腾气化时,不仅要破坏分子间的范德华力,而且还必须消耗较多的能量破坏分子间的氢键,因此,含有氢键的有机物较之分子量相近的其它有机物,应具有反常的高沸点。例如甲醇和乙烷:
| 分子量 | 结构 | 沸点(℃) | |
| 甲醇 | 32 | CH3OH | 64.9 |
| 乙烷 | 30 | CH3—CH3 | —88.6 |
醇的沸点反常高就是由于其分子间有较强的氢键而发生缔合。
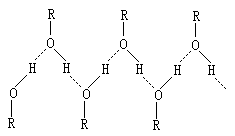
除了醇之外,酚、羧酸和胺等也含有氢键,其沸点也相应较高。

- 全部评论(0)
