氨水、氯水和溴水
时间:2016-01-19 22:25 来源:摘抄于因特网 作者:张世敏 点击: 次 所属专题: 溴水 氨水 氯水
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
“三水”,即氨水、氯水和溴水。它们在组成和性质上既相似,又不同。现作如下比较:
一、组成微粒
氨水的组成是“3+3”,即三种分子:NH3,H2O,NH3·H2O;三种离子:NH4+,OH-及少量H+。
氯水的组成是“4+4”,即四种分子:Cl2,H2O,HClO及少量O2;四种离子:H+,Cl-,ClO-及少量OH-。
溴水的组成是“4+4”,即四种分子:Br2,H2O,HBrO及微量O2;四种离子:H+,Br-,BrO-及少量OH-。
二、颜色气味
氨水是无色液体,氯水是浅黄色液体,溴水是黄色到红棕色液体。它们都具有刺激性气味,越浓越强烈。
三、与水反应不同
“三水”中的NH3、Cl2、Br2还会与水发生反应,其反应类型及难易程度不同。
氨水:NH3+H2O=NH3·H2O非氧化还原反应,容易)
氯水:Cl2+H2O=HCl+HClO氧化还原反应,缓慢)
溴水:Br2+H2O=HBr+HBrO氧化还原反应,极慢)
四、酸碱性不同
![]()
![]()
酸产生的白烟。
2NHCl2+2NaOH=NaCl+NaClO+H2O
溴水,Br2+H2O=H++Br-+HBrO,由于Br2与水反应极慢,产生的H+更少,酸性更弱。加入紫色石蕊试液基本上不变色,但用pH试纸测定,其pH=6,具有酸的性质。能和碱、金属等反应。如:
Br2+2NaOH=NaBr+NaBrO+H2O(溴水褪色)
五、氧化性及还原性不同
氨水具有较弱的还原性,可被强氧化剂氧化。如8NH3+3Br2=6NH4Br+N2(氨水使溴水褪色)。
氯水是强氧化剂,可将H2S、SO2、Fe2+、Br-、I-等氧化。
如:SO2+Cl2+2H2O=H2SO4+2HCl Cl2+2Br-=2Cl-+Br2
溴水的氧化性次于氯水,也能将H2S、SO2、Fe2+、I-等氧化。如:Br2+SO2+2H2O=H2SO4+2HBr
六、沉淀反应不同
氨水是很好的沉淀剂,可使多种阳离子:Mg2+、Fe3+、Al3+、Ag+、Zn2+、Cu2+等发生沉淀(有些沉淀不溶于过量的氨水,有些沉淀溶于过量的氨水)。如:
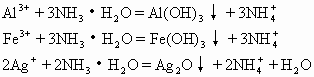
Ag2O+4NH3·H2O=2[Ag(NH3)2]++2OH-+3H2O
氯水只能使Ag+、Hg+沉淀。Ag++Cl-=AgCl↓(白色) Ag+ +Br-=AgBr↓(淡黄色)
七、见光或受热分解不同



八、漂白、杀菌和消毒作用
氯水有漂白、杀菌消毒作用,主要是因为氯水中有HClO,而HClO是很强的氧化剂,可使有色物质分子被氧化,或HClO跟有色物质的烯属官能团起加成反应等而褪色。HClO与有机物发生多种反应,因而可用来杀菌消毒。
氨水和溴水中无类似于HClO这种强氧化剂,所以它们无漂白、杀菌消毒作用。
氯水,Cl2+H2O=H++Cl-+HClO,显酸性,具有酸的通性。如能使紫 色石蕊试液变红,后褪色(次氯酸的漂白性),能和碱、金属、盐、金属氧化物等反应。

- 全部评论(0)
