学法指导:卤素知识体系
时间:2020-03-05 11:55 来源:摘抄于因特网 作者:张世敏 点击: 次 所属专题: 卤族 氯及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、知识体系
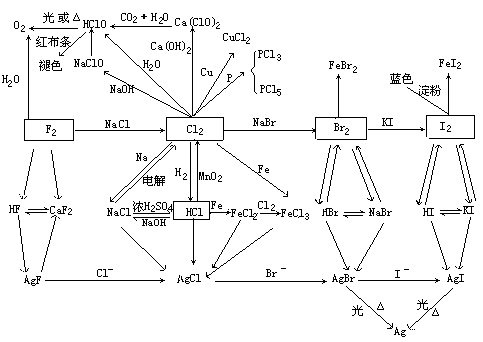
上面知识体系能帮助读者掌握代表物Cl2的制法、性质及其化合物HCl的制法、盐酸的性质、次氯酸的性质,并能掌握F2、Br2、I2及其化合物的重要性质、制法和X-的鉴别。
二、重点、难点知识
在卤素中,氯最重要,性质最典型,是学习的重点。难点是从电子转移观点理解氧化还原反应几对概念,以及氧化还原反应中电子转移的表示方法。
三、学习方法
1.以氯气的性质为重点,掌握氯气的性质、制法、用途和存在之间的关系。掌握氯气的实验室制法的反应原理、制备装置、收集方法和尾气处理。
2.在学习氯的基础上,以原子结构理论为指导、实验为基础,采用对比的方法学习氟、溴、碘,掌握卤素元素的共同性、递变性和特殊性。
(1)共性:
①卤素原子最外层都是7个电子;
②都是典型非金属元素,单质均为双原子分子;
③最高正价(氯、溴、碘)为+7价,此外还有-1,0,+1,+3,+5价(F无正价)且在自然界中均以化合态存在;
④与金属单质作用生成金属卤化物;
⑤与氢气化合形成卤化氢(HX);
⑥与强碱发生歧化反应;
⑦含氧酸盐具有较强的氧化性;
⑧单质都有毒;
⑨单质在有机溶剂中的溶解度比水中大;
⑩单质与水反应:X2+H2O→HX+HXO(X=Cl、Br、I)
(2)递变性:
A、原子结构和物理性质的递变规律
卤素原子随核电荷数的增大,电子层数逐渐变多,原子半径逐渐增大,(从F—I下同)单质颜色逐渐变深,密度逐渐增大,熔沸点依次升高,毒性逐渐减小,在有机溶剂中溶解度逐渐加大;列表如下:
元素名称 | 元素符号 | 核电荷数 | 原子结构 | 原子/离子半径 | 分子式 | 颜色 | 状态 | 熔沸点 | 密度 | 溶解性 | ||
氟 | F | 9 | 2 7 | 依 | 阴离子半径比相应原子半径大 | F2 | 依 | 气 | 依 | 依 | 与水反应 | 依次减弱 |
氯 | Cl | 17 | 2 8 7 | Cl2 | 溶解 | |||||||
溴 | Br | 35 | 2 8 18 7 | Br2 | 液 | 溶解 | ||||||
碘 | I | 53 | 2 8 18 18 7 | I2 | 固 | 微溶 | ||||||
B、原子结构和化学性质
①卤素原子随核电荷数的增大,原子半径逐渐增大,核对最外层电子的吸引力逐渐减弱,单质的氧化性(或非金属性或活泼性)依次减弱;
②与氢气化合能力由易到难,由强到弱,氢化物水溶液的酸性由弱到强,氢化物的还原性由弱到强;
③同一元素含氧酸随元素价态降低氧化性增强,酸性减弱(如氧化性HClO>HClO3>HClO4;酸性HClO<HClO3<HClO4);
④同一价态(Cl、Br、I)含氧酸氧化性增强,酸性减弱(如:氧化性HClO3<HBrO3<HIO3;酸性HClO3>HBrO3>HIO3);
⑤卤化银的颜色逐渐加深,溶解度逐渐减小。
需要掌握的列表如下:
元素 | 核电 | 原子 | 原子 | 单质 | 与氢气 | 与金属 | 氢化物性质 | 氢卤酸 | 与水反应 | X-还原性 | 最高价 | 卤化银 | ||
稳定性 | 还原性 | 颜色 | 溶解度 | |||||||||||
F | 9 | 依 | 依 | 依 | 由 | 由 | 依 | 依 | 依 | 依 | 依 | 依 | 逐 | 逐 |
Cl | 17 | |||||||||||||
Br | 35 | |||||||||||||
I | 53 | |||||||||||||
(3)特殊性:理出共性中的特殊性,有助于掌握特性,深化共性,达到灵活运用的目的:
①.氟只有-1价,无含氧酸、氟单质能与稀有气体反应,生成一系列化合物(如XeF2 KrF2等),氟单质与水发生置换反应:2F2+2H2O→4HF+O2;
②.氟化氢由于形成分子间氢键相互缔合,沸点反常的高;
③.氢氟酸是弱酸,只能部分电离,HF电离方程式为:HF H++F-,且能腐蚀玻璃:4HF+SiO2→SiF4↑+2H2O;
H++F-,且能腐蚀玻璃:4HF+SiO2→SiF4↑+2H2O;
④.AgX中只有AgF溶于水,且不具有感光性;CaX2中只有CaF2难溶于水;
⑤.F-易形成络合物(如Na3AlF6);
⑥.溴是唯一液态非金属,易挥发;
⑦碘易升华,遇淀粉变蓝,碘的氧化性较弱,它与具有多种价态的金属作用生成低价化合物(如FeI2、CuI);
⑧.溴、碘在不同极性的溶剂中生成不同颜色的溶液(如碘水,呈棕黄色;I2的CCl4溶液呈紫红色)。

- 全部评论(0)
