盐酸和醋酸的考点辨析
时间:2016-02-02 18:13 来源:未知 作者:汪峰 点击: 次 所属专题: 强酸与弱酸比较
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
强弱电解质的电离是高中化学的重点和难点,也是高考的热点。盐酸和醋酸作为一元强酸和一元弱酸的代表,其物质的量浓度的大小、c(H+)的大小、与活泼金属反应的速率、中和碱的能力等考点,学生往往对此迷糊不清,现对这几个方面进行剖析,供同学们参考。
难点剖析
1、物质的量浓度相同的盐酸和醋酸性质的比较
(1)c(H+)的大小:因为盐酸是全部电离,而醋酸是部分电离。故盐酸的c(H+)大于醋酸。
(2)与活泼金属反应的速率:在其他条件相同的情况下,活泼金属与酸反应的速率主要取决于溶液中c(H+)的大小。开始时盐酸的c(H+)大于醋酸,盐酸的反应速率较大,随着反应的进行两者的反应速率都逐渐减小,但醋酸减小的较慢,因为醋酸还有一个促进电离的过程。故随着反应的进行,醋酸的反应速率逐渐大于盐酸。
(3)中和碱的能力:酸碱是否完全中和,取决于其物质的量与反应的化学计量数的关系。即中和等物质的量的NaOH时,需盐酸的体积和醋酸的体积相同。也就是说物质的量相同的盐酸和醋酸其中和碱的能力是相同,至于反应后溶液的酸碱性则是由生成盐的性质来决定的。
(4)产生氢气的量:氢气的量由溶液中n(H+)的大小决定的,所以当溶液的体积相等时,两者产生的氢气量相同。
2、pH相同的盐酸和醋酸的性质比较
(1)物质的量浓度:pH相同即c(H+)相同,由于盐酸是全部电离,而醋酸是部分电离,所以盐酸的浓度远小于醋酸。
(2)与活泼金属反应的速率:开始时由于盐酸和醋酸的c(H+)相同,则与活泼金属反应时开始的反应速率是相同的。但在整个反应过程中醋酸的反应速率减小得较慢,故醋酸的反应速率大于盐酸,即制取相同体积的气体,醋酸的用的时间少。。
(3)中和碱的能力:中和等物质的量的NaOH时,所需盐酸和醋酸的物质的量相同。因为当pH相同时,盐酸的浓度远小于醋酸,故中和等物质的量的NaOH时所需盐酸的体积远大于醋酸的体积。
(4)产生氢气的量:当溶液的体积相等时,醋酸中n(H+)大,所以醋酸产生的氢气量大。
跟踪练习
练习1:常温下,现有①醋酸、②盐酸、③硫酸三种酸溶液,用编号填空:
(1)当三种酸的pH相同时,其物质的量浓度由大到小的顺序为:
(2)当三种酸的物质的量浓度相同时,其pH由大到小的顺序为:
(3)中和等体积、等物质的量浓度的NaOH溶液时,所需等物质的量浓度的三种酸溶液的体积关系为:
(4)体积和物质的量浓度相同的三种酸溶液,分别与同浓度的NaOH溶液反应,要使反应后的溶液呈中性,所需NaOH溶液的体积关系为:
(5)当三种酸溶液pH相同、体积相同时,分别加入足量锌,相同状况下产生气体的体积关系为
(6)当三种酸溶液pH的相同、体积相同时,分别加入足量锌,则开始时反应速率的关系。若产生相同体积的气体(相同状况下),所需时间的关系为
(7)将pH相同的三种酸溶液均稀释10倍后,pH的大小关系为 。
答案:(1)①>②>③;(2)①>②>③;(3)①=②>③;(4)①<②<③;(5)①>②=③
(6)①=②=③①<②=③;(7)①<②=③
练习2:等物质的量NaOH溶液分别用pH为2和3的醋酸中和,设消耗醋酸的体积依次为VA、VB,则两者的关系正确的是( )
A.VA>VB B.VA=10VB C.10VA>VB D.VB>10VA
答案:D
练习3(2010重庆化学13):pH=2的两种一元酸X 和Y,体积为100mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH(C=0.1mol L-1)溶液至,消耗NaOH溶液的体积为VX、VY,则( )
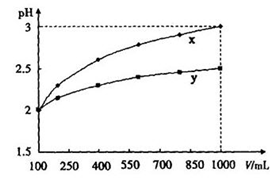
A.X为弱酸,VX<VY B.X为强酸,VX>VY,C.Y为弱酸,VX<VY,D.Y为强酸,VX>VY
答案:C
练习4:室温下,H+浓度相同的醋酸和盐酸,分别用水稀释至原来的m倍和n倍,稀释后两溶液的H+浓度仍相等,则m与n的关系是:m n (填大于、小于或等于)
答案:大于
练习5(2007上海化学13):下列关于盐酸和醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两溶液中c(H+)相同
B.100mL 0.1mol·L-1两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,都为5
D.两溶液分别加入少量对应的钠盐,c(H+)均明显减小
答案:B
练习6 pH=2的盐酸和醋酸溶液中,分别投入0.65g 锌粒,则下图中比较符合客观事实的是:( )
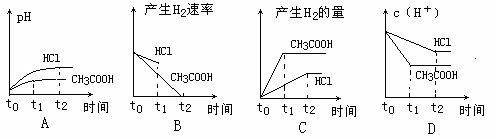
答案:A C

- 全部评论(0)
