元素最高价氧化物对应水化物的写法
时间:2014-12-06 19:05 来源:未知 作者:张红 点击: 次 所属专题: 最高价氧化物水化物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
元素最高价氧化物对应的水化物,这一概念出现在高中化学必修2元素周期律那章,用于判断元素金属性和非金属性强弱。元素最高价氧化物对应水化物碱性越强,则金属性越强;元素最高价氧化物对应水化物酸性越强,则非金属性越强。
有些同学对于元素最高价氧化物对应的水化物的写法不是很了解,下面我们做出总结。
首先我们把上述概念分开,先理解“元素氧化物对应的水化物”,简单理解,就是酸碱,金属氧化物对应水化物是碱,非金属氧化物对于水化物是酸。例如二氧化硫(SO2)对应水化物是亚硫酸(H2SO3),二氧化碳对应水化物是(H2CO3),氧化钙(CaO)对应水化物是氢氧化钙(Ca(OH)2)。到这里有的同学看出来了,所谓的氧化物对应水化物就是氧化物与水反应的产物,我们权且可以这样理解,(注:有些氧化物能直接与水反应,如二氧化硅SiO2,对应水化物为硅酸H2SiO3)。
那么最高价氧化物对应水化物是什么意思,我们就明白了,就是指最高价氧化物与水“反应”的产物。钠的最高价为+1,最高价氧化物为NA2O,对应水化物为氢氧化钠(Na2O+H2O=2NaOH);硫的最高价为+6,最高价氧化物为SO3,对应水化物为硫酸(SO3+H2O=H2SO4);
1.对于元素最高价氧化物水化物在写法一般有以下步骤:
(1)判断元素最高价:一般元素所在主族序数为最高正价(氧氟除外)。
(2)写出最高价氧化物
因为氧为-2价,然后计算元素最高价和氧元素化合价(-2)的最小公倍数,计算原子个数比。例如硫第6主族,最高价是+6价,所以公倍数是6,原子个数比1:3,最高价氧化物是SO3;氯,第7主族,最高价+7价,最小公倍数14,原子个数比2:7,最高价氧化物Cl2O7。
(3)最高价氧化物与水“反应”
例如,P2O5+3H2O(热)=2H3PO4(磷酸),P2O5+H2O(冷)=2HPO3(偏磷酸),所以磷酸和偏磷酸都是磷最高价氧化物对应的水化物。
2.对于未知的最高价氧化物对应水化物,我们可以通过下面的方法写出。
(1)金属对应碱
金属化合价最高价是几,后面加上几个氢氧根即可。
例如,钠+1价,那么NaOH,铝+3价,那么Al(OH)3,同理,氢氧化钙(+2),氢氧化钾(+1)等。
(2)非金属对应酸
非金属化合价最高价是几,首先后面跟几个氢氧根,然后将氢移到前面。删掉多余的水(H2O),剩下氢原子不超过4个。
碳+4价,那c(OH)4,然后将氢移到前面,得H4CO4,删掉一个水,得H2CO3;
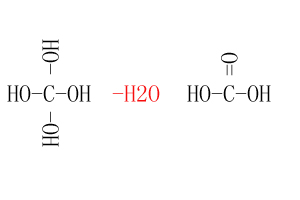
磷+5价,那p(OH)5,然后将氢移到前面,得H5PO5,删掉一个水,得H3PO4;删掉两个水,得HPO3;
硫+6价,那么S(OH)6,然后将氢移到前面,得H6SO6,删掉两个水,得H2SO4;
氯+7价,那么Cl(OH)7,然后将氢移到前面,得H7ClO7,删掉三个水,得HClO4。

- 全部评论(0)
(2181378090) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:我感觉我这么弄都满足了。删水剩下的氧原子小于等于4,H原子
(2338520581) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:太牛了秒回
(3492914144) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:我开始不知道的,看完过后现在会了,非常感谢您
(1165774722) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:补充一下,作者文章里说了:“剩下的氢原子不超过4个。”这一
(1165774722) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:应该是删到不能删为止,比如说cl,有7个H ,只能删3个水,然后
(18561506518) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:怎么判断到底要去掉几个水呢
(3482183648) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:二氧化硅好像不能直接与水反应吧?
(3482183648) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:二氧化硅好像不能直接与水反应吧?
(2201014082) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:谢谢,挺有用
(1772602268) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:意思大概是小于四个,可能是作者意思没表述好
(1772602268) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:意思大概是小于四个,可能是作者意思没表述好
(508423363) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:c是四键..............
(508423363) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:c是四键..........
(2247765312) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:可以,谢谢!
(527636868) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:磷H3PO4 H也没超过4啊,为啥还删
(2549388786) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:最高价和删去的水和为八
(1841255649) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:最起码要留一个H
(744396493) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:谢谢你!!!!!
(3386708787) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:白嫖真好,长芝士了
(3475969251) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:总要留氢吧
(2326916112) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:我没钱 不过谢谢
(2352425634) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:为什么氯是删去三个水,硫是删去两个水,这个删水有规律吗
(1817788389) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:啊哈哈哈,芝士了
(668855801984) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:不过谢谢了
(668855801984) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:不过谢谢了
(32588228) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:不好意思 白嫖
(2978860440) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:请问怎么判断删去几个水
(3455628967) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:谢谢你 对我很有帮助
(2601021996) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:一个或两个不还是不确定嘛,那咋呀
(2691416225) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:去到不能去为止了即去到化合物剩一个或两个H
。(3128907303) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:怎样判断删去几个水?
。(3128907303) 评论 href="/plus/view.php?aid=15211">元素最高价氧化物对:怎样判断删去几个水?
