P元素的最高价氧化物对应水化物是H3PO4,为什么N元素却是HNO3?
时间:2020-11-17 17:37 来源:未知 作者:化学自习室 点击: 次 所属专题: 最高价氧化物水化物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
P 元素的最高价氧化物对应水化物可以是 H3PO4,N 元素是 HNO3。为什么N不能 形成H3NO4?
在 H3PO4 中,P 原子采取 sp3 杂化,三个杂化轨道与 O 原子形成三个σ 键,另一个杂化轨道被孤对电子占据,这个孤对电子进入O原子提供一个空 2p 轨道,形成配位键。同时,O 原子将自己的两对孤对电子反馈给 P 原子的 3d空轨道形成反馈键——d-pπ 键,故 H3PO4 可用图 2(a)表示。配位键和反馈键构成的多重键,其键能与双键相近,具有双键的性质,故 H3PO4 可用图 2(b)表示。
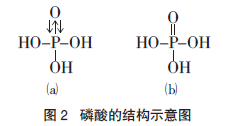
氮元素为什么不能形成 H3NO4?
第一,N 原子的孤对电子可以进入 O 原子的空 2p轨道形成配位键,但 N 原子却没有空轨道接受 O 原子的反馈电子对。
第二,N 原子半径较小,在狭小空间内连接三个羟基,使羟基 H 原子与另一羟基的 O 原子距离很近,从而形成较强的分子内氢键(H3PO4 分子中也存在分子内氢键)。形成氢键时,两个电负性大的原子越远越好,在大多数情况下,一个连接在 X 原子上的 H 原子只能与一个电负性大的Y 原子形成氢键,键角大多接近 180°(因为距离越远,电子云间的斥力越小)。在 N 原子周围狭小空间内的三个羟基,会产生强烈的相互排斥,使得 H3NO4 分子很不稳定,在分子内氢键的作用下脱去 H2O 分子并形成 N=O 键,形成图 3(a)所示的结构。
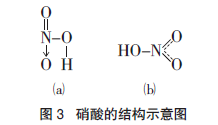
在图 3(a)结构中,N=O 和 N → O 之间会产生共振,形成共轭体系。从杂化理论分析,HNO3分子的 N 原子采取 sp2 杂化,π 轨道上的一对电子和两个 O 原子的成单 π 电子形成一个三中心四电子的不定域 π 键 π3 4 ,如图 3(b)所示。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
