中和滴定指示剂的选择原则
时间:2015-01-12 15:59 来源:未知 作者:董啸 点击: 次 所属专题: 指示剂选择
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、 一般选择原则
强酸滴定碱液:用甲基橙(甲基红更好,但一般不要求)
强碱滴定酸液:用酚酞
上述原则是基于视角角度,心理学研究证明:当溶液颜色由浅变深时易被观察到,反之则不易察觉,从而造成滴过量,产生误差。因此一般:
① 强酸滴定强碱时,应选甲基橙(或甲基红),因为滴定终点时溶液颜色由黄色→橙色;
② 强碱滴定强酸时,应选酚酞,因为滴定终点时溶液颜色由无色→红色;
③ 强酸滴定弱碱时必须选用甲基橙(或甲基红);
④ 强碱滴定弱酸时,必须选用酚酞。后两点选择原因下面另议。
另外石蕊一般不能作为中和滴定的指示剂,因为其变色不灵敏,且耗酸碱较多,造成较大误差。
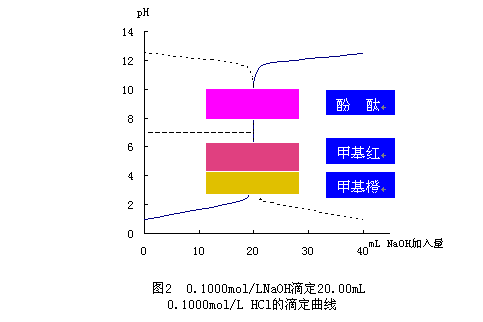
二、 从滴定准确度上看
由于滴定终点即为指示剂的变色点,它与酸碱恰好中和时的pH并不完全一致。
但从测定准确度看:上述一般原则能满足,下面对四种情况从计算角度加以说明。
1.用0.1mol.L_1HCl滴定20mL 0.1mol.L_1左右的NaOH溶液
当二者恰好中和时,pH=7,用甲基橙为指示剂,当溶液pH<4.4时,溶液颜色由黄色→橙色,为终点。这时盐酸已过量,假设过量一滴,约为0.05 mL,此时溶液中[H+]=0.05×10-3×0.1/(20+20)×10-3=1.25×10-4 mol.L_1,pH=3.9,此时的误差0.05/40=0.25%,只有千分之二的误差;所以强酸滴定强碱时,一般应选甲基橙(或甲基红更好)。
2.同理:若用0.1mol.L_1 NaOH滴定20mL 0.1mol.L_1左右的HCl溶液,用酚酞作指示剂,当pH>8时,溶液由无色→红色,为终点。这时NaOH已过量,假设过量一滴,约为0.05 mL,此时溶液中 [OH-]=0.05×10-3×0.1/(20+20)×10-3=1.25×10-4 mol.L_1,POH=3.9,pH=10.1此时的误差0.05/40=0.25%,亦只有千分之二的误差;所以强碱滴定强酸时,一般应选酚酞。
3.用0.1mol.L_1HCl滴定20mL 0.1mol.L_1左右的NH3·H2O溶液
当二者恰好中和时,因为产物为水解呈酸性的NH4Cl ,其[OH-]=(C×Kω/Kb)0·5=(0.05×10-14/1.8×10-5)0·5=5.3×10-6, pH=5.3,用甲基橙为指示剂,当溶液pH<4.4时,溶液颜色由黄色→橙色,为终点。这时盐酸已过量,同理此时只有千分之二的误差;若选用酚酞,pH<8时达终点,较之选用甲基橙误差更大,且不符合视觉要求。所以强酸滴定弱碱时必须选用甲基橙(或甲基红);
4.同理:若用0.1mol.L_1 NaOH滴定20mL 0.1mol.L_1左右的HAc溶液
当二者恰好中和时,因为产物为水解呈碱性的NaAc ,其[OH-]=(C×Kω/Ka)0·5=(0.05×10-14/1.8×10-5)0·5=5.3×10-6, POH=5.3,pH=9.7,用酚酞作指示剂,当pH>8时,溶液由无色→红色,,为终点。这时NaOH还差一点,此时的误差更小。若选甲基橙,则终点与指示剂的变色点相差太远,误差会很大,且不符合视觉要求。所以强碱滴定弱酸时,必须选用酚酞。
三、 其它滴定实验中指示剂的选择
1.双指示剂法
若有Na2CO3 、NaHCO3(或NaOH、Na2CO3)的混合物。可用标准盐酸选用不同指示剂进行分步滴定测出二者的含量:
方法:配制一定体积的待测液,用标准盐酸滴定,先加酚酞为指示剂,达终点时,溶液由红色→无色,测得耗盐酸V1,发生反应Na2CO3+HCl= NaHCO3+NaCl;再向其中加甲基橙,再达终点时,溶液由黄色→橙色,测得耗盐酸V2,发生反应NaHCO3+HCl= H2O+CO2↑+NaCl;据V1、V2的关系可求两盐的含量;
2.碘水与还原性溶液的氧化还原反应滴定
用碘水与无色的Na2S2O3溶液相互滴定,反应为2S2O32-+I2= S4O62-+2I-,可用淀粉为指示剂。当碘滴定Na2S2O3溶液时,溶液由无色→蓝色即达终点;反之溶液由蓝色→无色即达终点。
3.KMnO4溶液与还原性的亚铁盐、草酸等的氧化还原滴定
由于KMnO4溶液本身为紫红色的,而亚铁盐、草酸等色浅或无色,不必外加指示剂,KMnO4溶液本身兼具指示剂的作用,当KMnO4溶液滴定亚铁盐、草酸溶液时,终点为无色→紫红色;反之终点为紫红色→无色。
总之,对于属信息题的氧化还原滴定,若反应中只有一种物质的溶液有特殊明显的颜色,则此有色物本身为指示剂,不必外加指示剂。

- 全部评论(0)
