碳酸钠溶液和碳酸氢钠溶液定量分析
时间:2015-01-28 15:40 来源:未知 作者:胡长胜 点击: 次 所属专题: 碳酸钠 ph计算 碳酸氢钠01
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
已知:二元弱酸碳酸的解离常数:Ka1=4.2×10-7;Ka2=5.6×10-11。
(一)碳酸发生两步解离:
H2CO3 HCO3-+H+; HCO3-
HCO3-+H+; HCO3- H++ CO32-
H++ CO32-
∵Ka1≥100Ka2,说明H2CO3二级解离可忽略。
∴H2CO3以一级解离为主。
(二)Na2CO3溶液发生两步水解:
CO32-+H2O HCO3-+OH-; HCO3-+H2O
HCO3-+OH-; HCO3-+H2O H2CO3+OH-
H2CO3+OH-
根据共轭酸碱理论:
Kh1=Kw/Ka2=1.79×10-5; Kh2=Kw/Ka1=2.38×10-9
∵Kh1≥100 Kh2,说明Na2CO3二级水解可忽略。
∴Na2CO3溶液以一级水解为主,溶液显碱性。
(三)NaHCO3溶液发生水解和解离两个过程,应抓主要矛盾分析:
Kh2=Kw/Ka1=2.38×10-9;Ka2=5.6×10-11
∵Kh2>Ka2
∴NaHCO3溶液中HCO3-水解程度大于解离程度。以水解为主,溶液显碱性。
【已知】25℃碳酸在水溶液中的解离常数:Ka1=4.2×10-7;Ka2=5.6×10-11。
求:(1)25℃时0.01mol/L~0.1mol/L 碳酸钠溶液pH;(2)25℃时0.01mol/L~0.1mol/L 碳酸氢钠溶液pH。
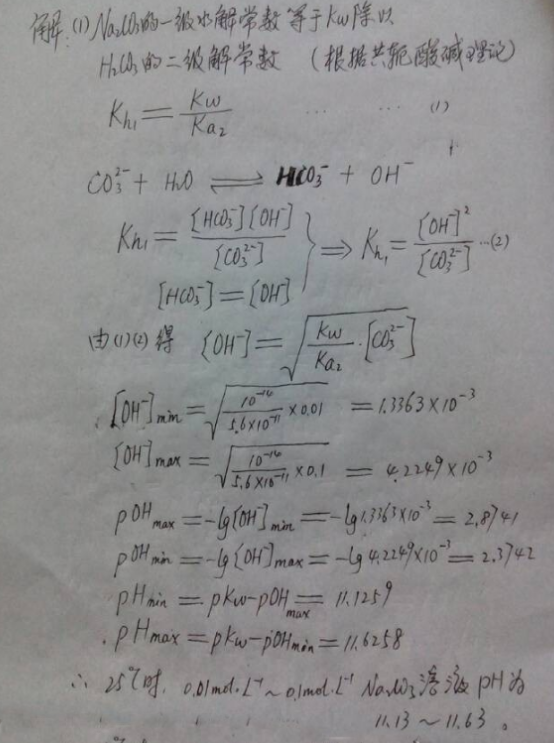

(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
