原子核外电子排布情况的推断
时间:2021-12-17 09:38 来源:化学原理补正的博客 作者:张瀚 点击: 次 所属专题: 核外电子排布规则
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
原子核外电子的排布情况与其化学性质密切相关。所以了解原子核外电子排布情况一直是各级化学教学中的一个重点,在无机化学及普通化学教学中也不例外。
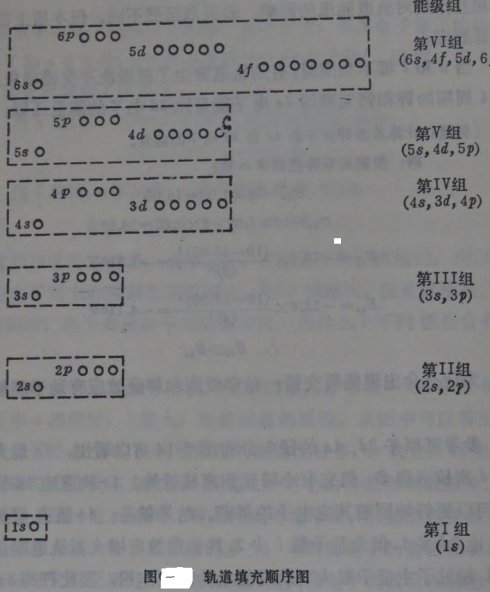
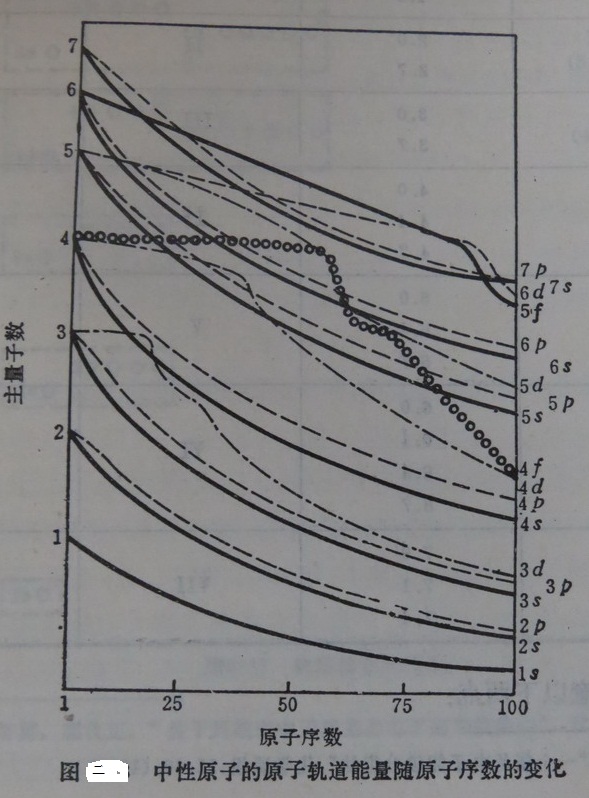
对比一下比较有影响的一些无机化学教材就可以发现,在说明这个问题时,它们都用到了两个图。一个是鲍林的“原子轨道的近似能级图”(图一),另一个是科顿的“原子轨道能级图”(图二)[1][2]。前者用于解决一般原子的核外电子排布式的写法问题,后者则能使学生更清楚地了解能级交错的具体情况。这是很好的。
一、
在教学中不难发现,由于“原子轨道的近似能级图”仍较为复杂,有较多地诸如、每个亚层含有的原子轨道数、能级组的划分等信息,能级高低表述的也并不明显,不便于观察和记忆。所以该图并不能很方便地帮助学生,使他们都能解决原子核外电子排布式的写法问题。
以至于有的教师只好告诉学生,要想独自写出一般原子的电子排布式,就要记住原子轨道的填充顺序为1S、2 S、2P、3 S、3P、4 S、3D、4 P、5S、4D、5 P、6 S、4F、5D、6 P……。这无疑是一个很笨拙,且意义不大的方法。
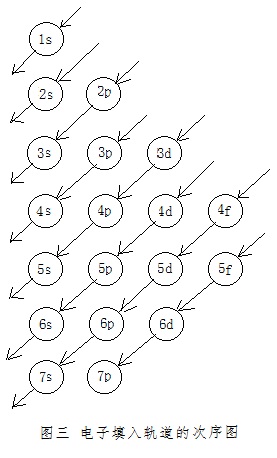
有的教材则能补充给出一个“电子填入轨道的次序图”(图三)来帮助学生记忆[3]。效果应该能不错。但该图还是有一些不够尽如人意的地方。
一是,能级的顺序,与同在该教材中的“原子轨道的近似能级图”及“原子轨道能级图”中能级的顺序正好相反。不便于反映出它与“原子轨道的近似能级图”间的关系。它并不比早在上世纪五十年代末期高中课本中就出现过的“电子填充次序图”(图四)更好。
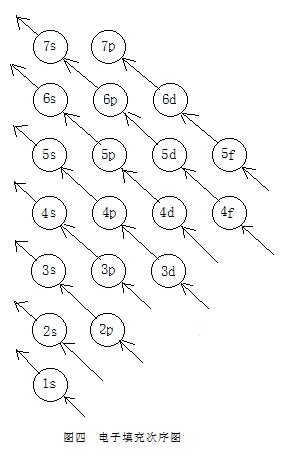
二是,在真正使用时,画出这一图还是略显麻烦。不一定要用圆圈来表示一个能级。如用方格来代表一个能级,则画图的速度能显著提高,使用起来也更为方便。
二、推荐的“电子填充次序简图”
如用方格来代表一个能级,可以将电子填充顺序图化简为“电子填充次序简图”(图五)。这一图与前面的图四、图三完全等价,用法也完全相同。
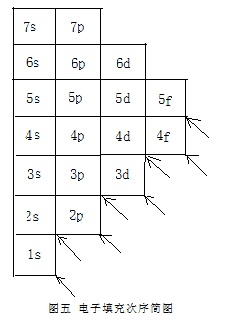
电子填充次序简图在教学中还可以把许多重要的知识概括起来。通过该图的延伸版“电子填充次序教学图”(图六)的讲解,还能使学生掌握更多的信息。
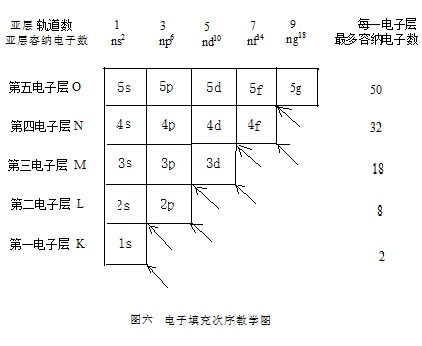
由于电子填充是建立在核外电子运动状态描述的基础之上的,所以“教学图”一定要与所有描述原子核外电子运动状态的知识紧密地结合起来:
1、该图形象地表示出核外的电子是分层排列的。按电子的平均能量和离核距离,分别有第一电子层、第二电子层、第三电子层……(即主量子数N = 1、2、3、4、5…,光谱学符号为K、L、M、N、O……)。随主量子数的增加电子的平均能量和离核距离要依次增加。
2、每个电子层包含有数目不等的亚层(也就是能级)。不同的亚层,要用不同的符号来表示,且与角量子数相关。如L= 0、1、2、3……的亚层,其光谱学符号分别为s、p、d、f、g……。
又由于角量子数的取值范围是受主量子数制约的,L= 0、1、2、3……(n -1),在每个电子层中,角量子数(亚层)的个数为n。这样,K、L、M、N、O电子层包含的亚层数分别为1、2、3、4、5…,每个电子层的主量子数与其含有的能级数相等。如,第三电子层含有三个能级。第四电子层含有4个能级。
3、在不同亚层、也就是不同能级中,所含有的原子轨道数也是不同的。原子轨道的数目要受角量子数的限制。亚层的角量子数(l)与其包含的原子轨道数的关系为,轨道数=(2l+1)。这样,当角量子数L分别为0、1、2、3、4时,其对应能级的轨道数分别为1、3、5、7、9…。
由于每个轨道最多可以容纳自旋相反的两个电子,这样s、p、d、f、g能级,最多容纳的电子数就依次是2、6、10、14、18…。
由此也可以算出随n的增加,各电子层最多容纳的电子数分别为2、8、18、32、50…。
另一方面,能反映出电子相互作用对各能级的影响
4、对氢原子来说(原子核外只有1个电子时),同一电子层中各亚层的能量是相同的。如M电子层的3s、3p、3d亚层,在图中都处于相同的高度E3s= E3p= E3d。
5、对多电子原子(多于1个电子的原子)来说,电子间的相互影响是从两个方面体现出来的。
一是,造成能级分裂,处于同一电子层的诸亚层的能量不再相等。如同样是处于M电子层的3s、3p、3d亚层,其能量不再相等,而是E3s<E3p<E3d。如果有1个电子要填入该电子层的话,应尽先填入能量最低的3s轨道。
另一点是,产生了能级交错的现象。即能级的能量不完全由主量子数来决定,主量子数较高的某能级的能量,甚至于比主量子数较低的某能级的能量还低。如4s与3d能级相比较,一般是前者的能量高,但在某些情况下也会出现E4s<E3d的情况。
考虑到核外多电子间的相互作用,将核外电子由能量从低到高填入“电子填充次序简图”时,应将观察的方法略加改变。
以1s格为轴心、将整个图稍稍逆时针转动,相当于对该图依次由右下到左上画出每个方格的对角线后、由低到高,沿对角线方向逐行看上去的结果。也就是电子填充的顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d…。
据此,就可以把绝大多数元素的原子核外电子排布式顺利写出来。
再一方面,能反映电子填充顺序与元素周期表的关系
6、能级组是电子填充顺序的必然结果。
能级组一般是由,以ns开始、含有(n-2)f及(n-1)d、到np结尾的,一系列能级构成的。在“电子填充次序教学图”中,一个能级组一般是由ns、np及np右下方的几个能级构成。
由于第一电子层没有1p能级,所以第一能级组只有1s这一个能级,相应的元素周期表的第一周期也是一个特短周期;由于2p的右下方没有1d能级,所以第二能级组只有2s和2p,这两个能级;由于3p的右下方没有2d能级,所以第三能级组也只有3s和3p这两个能级,第二和第三周期都是只有8个元素的短周期;而在4p的右下方有3d能级存在,但没有2f能级,所以第四能级组有4s、3d和4p,这三个能级:第五能级组同样也只有5s、4d和5p,这三个能级(2f能级不存在):第六能级组则由6s、4f、5 d和6p,这四个能级构成;……。
不难看出,第二和第三周期都是含有2个s区元素和6个p区元素的“短周期”,而第四和第五周期都是含有2个s区元素、10个d区元素和6个p区元素的“长周期”。
可见,由“电子填充次序教学图”可以归纳出许多让人们感兴趣的东西。应该将其引入化学教学。
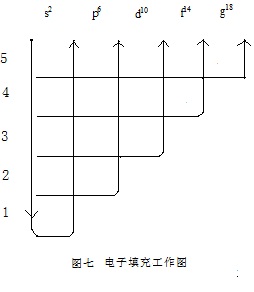
如果只是为了写出某原子的核外电子排布式,该图还可以简化为用更简单的由5条线来给出的“电子填充工作图”(图七)。每个学生都能几笔就在草纸上将这种图画出来。在教学中,应该把这个工具交给学生、帮助他们在理解的基础上进行科学的记忆。
三、洪特规则的影响
就“电子填充工作图”,考虑能量最低原理和不相容原理,就可以写出多数原子的核外电子排布式。但仍有一些还难免与实际不符。
要写出原子核外电子排布的轨道表示式,或让更多的原子核外电子排布式与实际吻合,就必须要同时考虑洪特规则的影响。
洪特规则有两层含义。一是,在n和l相同的简并轨道上分布的电子,将尽可能分占m不同的轨道,且自旋平行。另一点是,在等价轨道上的电子排布采取全充满和半充满状态时,能量会较低、体系有更大的稳定性。
如,属于第四周期的24号元素Cr(铬)的外层电子构型,不是d4s2、而是d5s1;而29号元素Cu(铜)的外层电子构型,不是d9s2、而是d10s1。这两个“特例”,分别是由于D轨道的半充满及全充满造成的。
在第五周期,由于d轨道的半充满及全充满造成的“特例”则更是有6个之多。
41号元素Nb(铌)的外层电子构型,不是d3s2、而是d4s1(d轨道接近半满);
42号元素Mo(钼)的外层电子构型,不是d4s2、而是d5s1(d轨道半满);
44号元素Ru(钌)的外层电子构型,不是d6s2、而是d7s1(d轨道接近全满);
45号元素Rh(铑)的外层电子构型,不是d7s2、而是d8s1(d轨道接近全满);
46号元素Pd(钯)的外层电子构型,不是d8s2、而是d10s0(d轨道全满);
47号元素Ag(银)的外层电子构型,不是d9s2、而是d10s1(d轨道全满);
而在第六周期,除了d轨道的全充满在2个元素有体现外,其半充满的作用并没有被体现出来。但5d对4f轨道填充的影响却在2个元素中表现出来了。
78号元素Pt(铂)的外层电子构型,不是d8s2、而是d9s1(d轨道接近全满);
79号元素Au(金)的外层电子构型,不是d9s2、而是d10s1(d轨道全满);
44号元素La(镧)的外层电子构型,不是f1s2、而是d1s2(f轨道全空);
45号元素Gd(釓)的外层电子构型,不是f8s2、而是f7d1s2(f轨道半满);
在第七周期,即使到106号元素D轨道的影响也无法体现出来,只在6个元素中有6d对5f轨道填充的影响。由于很难遇到,这里就不再列出。
在实际教学中,应以学生考虑到洪特规则,能解释上述6个周期12个“特殊”的电子构型,能独立写出24号元素Cr(铬)、29号元素Cu(铜)、47号元素Ag(银)、79号元素Au(金)的核外电子排布式,为教学的最高要求。
参考文献
[1]北京师范大学等校无机化学教研室编.无机化学(第三版).高等教育出版社. 1992
[2]大连理工大学无机化学教研室编.无机化学(第三版).高等教育出版社. 1990
[1]武汉大学等校编.无机化学(第二版).高等教育出版社. 1988

- 全部评论(0)
 天涯凯旅 评论
href="/plus/view.php?aid=15533">原子核外电子排布情: 加油
天涯凯旅 评论
href="/plus/view.php?aid=15533">原子核外电子排布情: 加油
