相对原子质量相关概念解析
时间:2016-01-22 18:47 来源:未知 作者:张楠 点击: 次 所属专题: 原子量
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、原子质量
一个原子的真实质量,即原子的绝对质量,例如:一个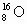 原子的质量为
原子的质量为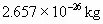 ,一个
,一个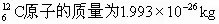 。
。
说明:由于原子质量的数字太小,使用不方便,科学上一般不采用。
二、同位素原子的相对原子质量
同位素原子的原子质量(真实质量)与原子质量的
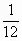 的比值,例如:
的比值,例如: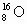 的相对原子质量
的相对原子质量
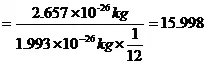 .
.
说明:由于同位素原子的相对原子质量是个比值,所以原子的相对原子质量的单位是1.
三、原子的质量数
忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来所得的数值叫质量数。原子的质量数(A)=质子数(Z)+中子数(N)。
说明:①原子的质量数不是同位素的相对原子质量,也不是元素的相对原子质量
②相对原子质量有小数,质量数是整数,但原子质量数可近似的代表原子的相对原子质量(即为原子的近似相对原子质量)
四、元素的相对原子质量(元素的平均相对原子质量)
元素的相对原子质量等于各同位素原子的相对原子质量与其丰度的乘积之和(丰度是指自然界中每种同位素原子占整个元素原子个数的百分比)。
公式:Ar=Ar1×a%+Ar2×b%+Ar3×c%(Ar1、Ar2、Ar3、表示各同位素原子的相对原子质量,a%+b%+c%=1)
例如:氧元素有三种天然同位素,数据如下表;
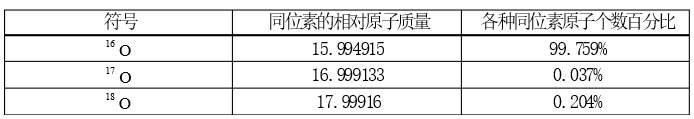
则依据公式,氧元素的相对原子质量为:
Ar=15.994915×99.759%+16.999133×0.037%+17.99916×0.204%=15.9994
说明:元素周期表中元素的相对原子质量的数值就是这样算出来的。
区分丰度和同位素原子的质量百分数
丰度是同位素原子的原子个数百分比(物质的量百分比),指某同位素的原子总数(或物质的量)占该元素的总原子数(或总物质的量)的百分度。
同位素原子的质量百分数指同位素原子的总质量占该元素的总质量的百分数
五、元素的近似相对原子质量
元素的近似相对原子质量等于各同位素原子的质量数与其丰度的乘积之和。(即用原子的质量数代替相对原子质量参加计算)
公式:A=A1×a%+A2×b%+A3×c%(A1、A2、A3、表示各同位素原子的质量数,a%+b%+c%=1)
例如:根据上表中数据,氧元素的近似相对原子质量为:
A=16×99.759%+17×0.037%+18×0.204%=16.00445
说明:相对原子的相对原子质量而言,质量数是近似值,故这种计算方法所得数值称为元素的近似相对原子质量,它与元素的平均相对原子质量有本质上的区别。

- 全部评论(0)
