用n+0.7l法比较原子轨道能量
时间:2016-05-16 09:07 来源:未知 作者:罗成 点击: 次 所属专题: 构造原理 能级09
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
学习苏教版高中化学选修3《物质结构与性质》这本书的专题1时,会讲到原子核外电子的排布原理:①能量最低 原理:电子先占据能量低的轨道,再依次进入能量高的轨道; ②泡利不相容原理:每个轨道最多容纳两个自旋状态不同的 电子;③洪特规则:在能量相同的轨道上排布时,电子尽可能 分占不同的轨道,且自旋状态相同.
学生在学习能量最低原理时,就必须按照书上13页的图 (如图1所示),记住各个轨道能量的高低。
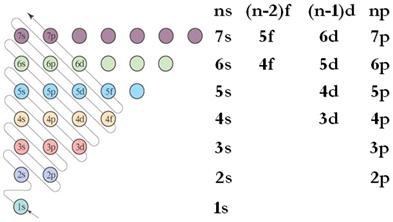
图1存在三个缺陷:一是图形比较难画,要画出比较规范醒目的图形是不容易的;二是图形顺序斜线上升,不适应人们 视觉记忆“上、下、左、右”的习惯;三是不易于记忆,容易把轨道填充顺序记错。
笔者根据教学实践,认为死记上图,不如记忆北京大学徐光宪院士归纳的近似规律好。即:对于原子的外层电子轨道, n+0.7l值越大,则能量越高。
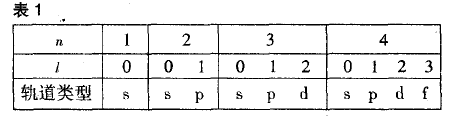
n为主量子数,即电子层数;l为角量子数,取值范围为: 0≤l≤n-1的整数,n、l与轨道类型之间的关系见表1:
只要知道n和l的值,各种轨道能量的高低就很好比较.。现枚举几例——只需比较n+0.7l的大小:
例1、不同电子层上的同一轨道能量高::ls<2s<3s<4s (n+0.7l 比较:1<2<3<4)。
例2、同一电子层上各轨道能量高低:ns<np<nd<nf(n+0.7l 比较:n<n+0.7<n+1.4<n+2.1)。
例3、同一电子层内形状相同而伸展方向不同的轨道,能 量相等,如:2px=2py=2pz (n均等于2,l均等于l,n+0.7l值相 等)。
例4、核外电子的轨道能量的大小:ls<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p. (n+0.7l比较:1<2 <2.7 <3 <3.7 <4 <4.4<4.7 <5 <5.4 <5.7 <6 < 6.1<6.4<6.7)。
训练题:
A.3px= 3pz B.4s<3d c.4p="">4f D.7s<6d
【参考答案】
A. 轨道3Px和3pz的l值均等于1,对应的n+0.7l均等于 3+0.7=3.7,能量相等,正确。
B. 轨道4s对应的n+0.7l=4,轨道3d对应的n+0.7l = 3+0.7 ×2=4.4,正确。
C. 轨道4p对应的n+0.7l=4+0.7=4.7,轨道4f对应的n+ 0.7l=4+0.7×3=6.7,4p<4f,错误。
D. 轨道7s对应的n+0.7l=7,轨道6d对应的n+0.7l = 6+0.7 × 2=7.4,正确。

- 全部评论(0)
(1335474281) 评论 href="/plus/view.php?aid=15772">用n+0.7l法比较原子轨:这个自习室好
