电子转移数目容易标错的氧化还原反应
时间:2016-03-27 10:38 来源:濮阳市油田三高 作者:周书峰 点击: 次 所属专题: 电子转移数目
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氧化还原反应是高中化学教学的重点之一,多 年来高考都十分重视对这部分知识的考査。考纲要 求“了解氧化还原反应的本质是电子转移,了解常见的氧化还原反应。”其中关于电子转移数目的计算是 高考命题的常见题型。
笔者在教学中发现,学生最容易出现的错误集中在某几类反应中。于是我进行了归纳,并形成了小专题,以引导学生对此难点进行突破。现将我的归纳和 突破方法总结如下,以供同学们参考,也希望在同行中抛砖引玉。
一、同种元素不同价态的原子间发生的电子转移
这类氧化还原反应最显著的特征是同种元素在反应物和生成物中均出现两次或两次以上。
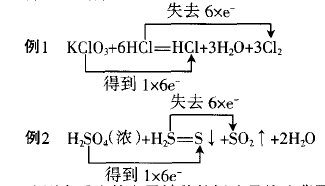
这两个反应的电子转移的标法显然违背了氧化还原反应“互不交叉”的规律,故而出错。所谓“互不交叉”规律,可以表述为:同种元素不同价态之间,相邻价态不反应,不相邻价态间发生反应时化合价只向中间价态靠拢,但不交叉。
在实际教学中,如果仅给出上述规律,能理解的 学生只有一部分,能熟练运用到具体分析中的仅是 一小部分,于是我和我的学生将具体操作分解成如 下三部分:
①找出反应前后未变价的原子种类和数目(因 H、O显然未变,故忽略)
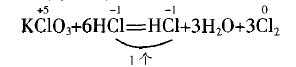
(此处之所以用弧线是为了区别线桥)
含义:这1个-1价的Cl在反应物中既没有发生氧化反应又没有发生还原反应,即它既不是氧化剂又不是还原剂,它在生成物中既不是氧化产物又不是 还原产物。同时明确,另外5个-1价的Cl是参加了氧 化还原反应的。
②连线桥
起点:等号左边凡是发生变价的该元素,肯定是线桥的起点。
终点:排除未变价的该元素数目,观察等号右边该元素价态有几种,如果只有一种,如例1中只有0 价Cl,则所有线桥终点均指向这里,即:
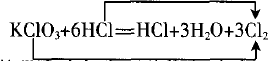
如果等号右边仍有两种价态,如例2中有0价、+ 4价S,则“高价连高价”+6→+4,“低价连低价”-2→0,可以记为“高高低低”。
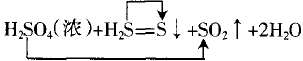
③计算电子转移的数目
例1中,6个-1价Cl中只有5个参与了氧化还原反 应,且从-1价到0价,故失去 5×e-。
于是就很容易得到如下的正确分析:
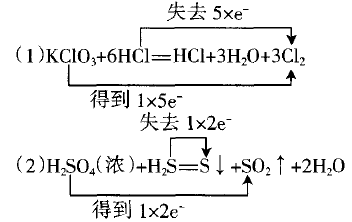
需要说明的是,上述两个例子还是比较简单的, 若用分解的三步完成似乎有点大动干戈之嫌,但用 来处理较复杂的氧化还原反应时就显出它的条理来 了,如用于多种氧化剂(还原剂)或多种氧化产物(还 原产物)的反应。
二、多种氧化剂(还原剂)、多种氧化产物(还原产物)
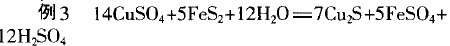
用三步分析法:
①先排除未变价部分S元素的原子
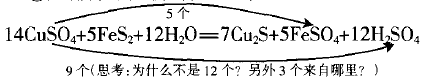
②连线桥
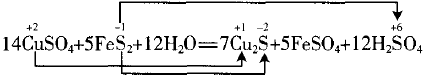
分析:在参加反应的共10个-1价S原子中,有7个 变为-2价,有3个变为+6价。
③根据价态变化计算电子转移数
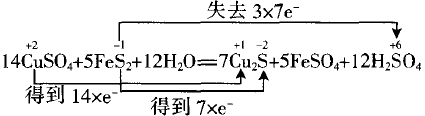
三、缺失部分氧化剂(还原剂)的反应
例4:
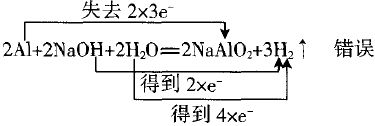
错误原因是该反应中NaOH不是氧化剂。
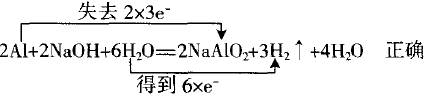
因为这种情况少见,故不再展开,只作为特例。

- 全部评论(0)
