氧化还原反应电子转移数目的判断
时间:2016-03-25 10:58 来源:未知 作者:武群 点击: 次 所属专题: 电子转移数目 双线桥法
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氧化还原反应电子转移电子数目的判断,一直是困扰许多学生的一个难点,根据自己多年的教学经验,特总结如下:
对于双箭桥表示法,电子转移数表示为:A×B e-形式,
其中 A为反应前后化合价变化的原子个数;B=高价态—低价态,A=1 或B=1 将 省略
对于单箭桥表示法,电子转移数表示为:M e-形式,
M=A×B,当 M=1 时,将1省略,A、B 的意义与双箭桥表示法中的相同。
例:分析下列氧化还原反应,标出电子转移的方向和数目
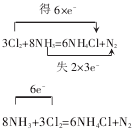
(1)3Cl2+8NH3=6NH4Cl+N2
解析:用双箭桥表示,氯元素的原子化合价全部降低,都由 0价降低到-1 价,A=6,B=0-(-1)=1,故可写为:得 6×e-;氮元素反应前是 8 个原子,反应后只有2 个原子的化合价由-3 价升高到0 价,A=2,B=0-(-3)=3,故可写为:即可写为:失2×3e-
用单箭桥表示,M=6×1或M=2×3, 均可得到M=6,即表示为:6e-,该反应可表示为:
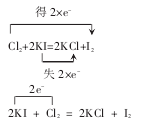
(2)Cl2+2KI=2KCl+I2
解析:氯元素的原子化合价全部由 0 价降到-1价,用双箭桥表示,即 A=2,B=0-(-1)=1,可表示为:得 2×e-;碘元素的原子化合价全部由-1价升到 0 价,由双箭桥表示,即A=2,B=0-(-1)=1,可表示为:失 2×e-;
用单箭桥表示为:2e-.
该反应可表示为:
以上仅是本人的一点心得,希望能给同学们学习带来一些帮助.
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
(2798710134) 评论 href="/plus/view.php?aid=15826">氧化还原反应电子转:请教一下如果是2H2S+SO2=3S↓+2H2O的转移电子数目应如何计算
(2138887969) 评论 href="/plus/view.php?aid=15826">氧化还原反应电子转:太赞了。。。。
还没有评论,快来抢沙发吧!
