谈谈化学反应方程式的叠加
时间:2016-03-27 12:13 来源:未知 作者:刘玉林 点击: 次 所属专题: 叠加法 多步反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有些体系不只涉及一个反应,并且不同的反应之间存在着某种相互联系,对于这样的体系,进行化学反应方程式的叠加常可使有关问题获得简便的解决。化学方程式的叠加的关键问题是量的关系的衔接和确定。下面,笔者将分两种情况说明 之。
一、相继反应方程式的叠加
有些情况下当前一个反应的产物作为后一个反应的反应物时,这样联系着的反应可以称为相继反应(区别于动力学中 的连续反应概念)。相继反应在量的关系上存在着连续的规定 性,通过反应方程式的直接叠加即能达成不同反应间的量的贯通。
例1.现有含FeS2 50%的硫铁矿150吨,用接触法生产硫酸。
(1) 最少需要通常状况下的空气多少升?
(2) 可制得98%的硫酸多少吨?
(通常状况下氧气密度1.3克/升,空气中氧气的体积百分含 量为21%)
[分析与解答]
接触法生产硫酸包括三个化学反应:
4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
2SO2+O2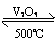 2SO3
2SO3
SO3+H2O = H2SO4
设最少需要空气x升,可制得98%硫酸y吨。由上述反应方程式的叠加得如下方程式:
4FeS2+15O2+8H20=8H2SO4 + 2Fe2O3
4×120 15×32 8×98
150×50% x×21% ×1.3×10-6 y×98%
480:480=75:2.73×10-7x
x=2.747×108(升)
480:784=75:y×98%
y=125(吨)
答案:见分析与解答。
二、交联反应的叠加
当同时存在的几个反应是相对独立地进行,它们在量的关系 上发生一定的交联或存在着相互制约性(不同于相继反应中后一 反应的实际用量单方面受前一反应的制约),这样的反应可称之为交联反应(区别于动力学中的平行反应概念)。进行交联反应方程式的叠加应当先确定出混合物组分的物质的量之比或是用待定系数法处理。
例2.将某碳酸钠和碳酸氢钠混合物2.74克加热到质量不再 变化时,剩余物质质量为2.12克。再取该样品若干,加人某浓度 的盐酸100毫升,恰好完全反应。生成二氧化碳672毫升(标准状 况)。
求:1.混合物中碳酸氢钠的百分含量。2.盐酸的摩尔浓度。
[分析与解答]
(1)设混合物中NaHCO3为x克。
2NaHCO3=Na2CO3+CO2 +H2O 差量
168 106 62
x (2.74-2.12)
168:62=x:0.62
x=1.68(克)
NaHCO3%=1.68/2.74×100%=61.3%
(2)设盐酸摩尔浓度为y摩/升。
NaHCO3+HCl=NaCl+CO2 +H2O
Na2CO3+2HCl=2NaCl+CO2 +H2O
混合物中Na2CO3和NaHCO3的物质的量之比为
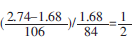
所以
Na2CO3+2NaHCO3+4HCl=3NaCl+3CO2 +3H2O
4 3×22.4
y×100/1000 672×10-3
4:67.2=0.1y:0.672
y=0.4(摩/升)
答案见分析与解答。
例3.将适量CO2通人含NaOH 0.8克的溶液中,在低温下缓 缓蒸干所得的溶液,得到1.37克固体。
求:(1)通人CO2气体的质量。(2)所得固体的组成。
[分析与解答]
由题意可知CO2和NaOH反应后均无剩余。发 生的化学反应可表示为:
CO2+2NaOH=Na2CO3+H2O
CO2+NaOH=NaHCO3
设生成Na2CO3 x摩,NaHCO3 y摩。
由待定系数法:
(x+y)CO2+(2x+y)NaOH=xNa2CO3+yNaHCO3+xH2O
44(x+y) 40(2x+y) 106x+84y
0.8 1.37
40(2x+y)=0.8
106x+84y=1.37
解之得:x=0.005 摩,y=0.01 摩。
Na2CO3 的质量=0.005x106=0.53 克,
NaHCO3 的质量=0.01x84=0.84 克
通入CO2质量=44(x+y)=44(0.005+0.01)=0.66(克)
答案:见分析与解答。

- 全部评论(0)
