苯酚的饱和溶液与氢氧化铜反应吗?
时间:2016-05-13 09:02 来源:未知 作者:李兴 点击: 次 所属专题: 苯酚 氢氧化铜
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
目前,广大教育工作者对苯酚的饱和溶液与氢氧化铜是否反应说法不一,笔者从理论和实验两个层面对这一问题进行了 探讨。
1、理论计算
(1) 计算氢氧化铜在水中达到溶解平衡 时,氢氧化铜电离出的OH-的物质的量浓度(忽略水电离的影响)。
查表[1]可知,25°C时,Ksp[Cu(OH)2]=2.2 × 10-20。则:c(OH-)[Cu(OH)2] =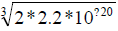 =3.5× 10-7(mol/L)。
=3.5× 10-7(mol/L)。
(2) 计算苯酚的饱和溶液中H+物质的量浓度。
查表可知,25 C 时,Ka(C6H5OH)=1.0 × 10-10。
若想计算苯酚的饱和溶液中C(H+),必须知道20 ℃时苯酚的溶解度。中学教材只描述为常温下苯酚在水中的溶解度不大, 大学教材高鸿宾主编的《有机化学》中苯 酚的溶解度为8g,吉林师范大学等五院校合编的《有机化学》中苯酚的溶解度约为 9g,版本不同数据不同,按那个数据计算? 笔者自己动手测定了苯酚在水中的溶解度,装置如图1。
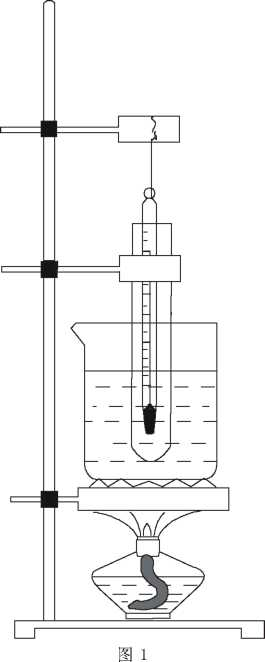
实验步骡有以下几点。
(1)用托盘天平称取1g稍带粉红色的苯 酚晶体,放入大试管中。
(2 )用10mL量筒量取10mL蒸馏水,加 入到大试管中,充分振荡,形成乳浊液,再 将试管放入水浴中,以控制分散系的温度 为 20℃。
(3 )用10mL量筒量取10mL蒸馏水,用 滴管从量筒中吸取水,逐滴滴入到大试管 中,边滴边充分振荡(振荡时取出温度计), 直到乳浊液中的小液滴完全消失为止。此 时,量筒内剩余蒸馏水7.6mL。
(4) 再用10mL量筒测量所配制的苯酚 饱和溶液的体积为13.6mL。
(5) 计算:20 ℃时,苯酚的饱和溶液中:c(C6H5OH)=1g÷ (94g/mol×0.0136L) =0 . 78mol/L,c(H+)(C6H5OH) =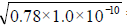 =8.8 × 10-6(mol/L)
=8.8 × 10-6(mol/L)
(6) 计算苯酚的饱和溶液与氢氧化铜反 应的可能性。
c(OH-)[Cu(OH)2]× c(H+)(C6H5OH)=3.5× 8.8 × 10-6=3.1 × 10-12>1.0 ×10-14
故理论上苯酚的饱和溶液与氢氧化铜 能够反应。
2、实验验证
(1) 制取氢氧化铜:在试管里加入2%的 CuSO4溶液1mL,滴入10%的NaOH溶液至稍 过量,用蒸馏水洗涤至上层清夜pH=7为 止,倒出上层清夜。
(2) 配制室温下苯酚的饱和溶液。
(3) 苯酚的饱和溶液与氢氧化铜的反 应:为了使实验更严谨,笔者设计了对比 实验,分别取3mL蒸馏水、3mL苯酚的饱和 溶液于二支试管中,各滴入4滴氢氧化铜 悬浊液,充分振荡,静置。可以看到,原盛 蒸馏水的试管中有蓝色沉淀,原盛苯酚的 饱和溶液的试管中有绿色沉淀。说明苯酚 的饱和溶液与氢氧化铜确实发生了化学 反应,且生成的苯酚铜难容于水。反应原 理如下:
2C6H5OH + Cu(OH)2 = Cu(C6H5O)2 +2H2O
(4)探讨苯酚铜的溶解性:取0.5g苯酚 于试管中,加入2mL蒸馏水,充分振荡后 滴入10%的NaOH溶液至乳浊液变澄清,滴 入4滴氢氧化铜悬浊液,振荡,溶液中有绿 色沉淀产生,再滴入醋酸溶液,绿色沉淀 消失。
实验说明苯酚铜比氢氧化铜更难溶与 水,但能溶于稀酸。
反应原理如下:2C6H5ONa+Cu(OH)2 = Cu(C6H5O)2 + 2NaOH
(C6H5O)2Cu+2CH3COOH=(CH3COO)2Cu+2C6H5OH
综上所述,不论是理论计算,还是实 验,都证明了苯酚的饱和溶液与氢氧化铜能够反应。

- 全部评论(0)
(828276373) 评论 href="/plus/view.php?aid=15979">苯酚的饱和溶液与氢:够严谨,非常细心
