例析离子核外电子排布式的书写
时间:2016-05-17 21:16 来源:未知 作者:王亚娟 点击: 次 所属专题: 电子排布式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
核外电子排布式是贯穿《物质结构与性质》的一条主线,通过核外电子排布式可以很清楚地了解原子的结构,对于元素性质的研究有着重要的作用。人教版高中化学选修3《物质结构与性质》教材中,对于原子的核外电子排布式作了详细的讲解,但对于离子基态核外电子排布式并未作介绍,然而在高考化学选考题中却常常涉及离子的核外电子排布式。本文重点例析离子核外电 子排布式的书写。
【例1】(2013年新课标Ⅱ卷第 37题)前四周期原子序数依次增大的 元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且 A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原 子序数相差为2。
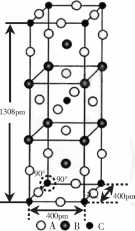
图1
回答下列问题:
(1) D2+的价层电子排布图为
(2) 四种元素中第一电离能最小的 是 ,电负性最大的是_____ 。(填元素符号)
(3) A、B和D三种元素组成的一个化合物的晶胞如图1所示。
①该化合物的化学式 为___ ;D的配位数为___
②列式计算该晶体的密 度___ g • cm-3。
(4) A-、B+和C3+三种离子组成的化合物B3CA6, 其中化学键的类型有 ;该化合物中存在一个复杂离子,该离子的化学式为
解析:根据题目信息可推得A、B、C、D分别为F、K、 Fe、Ni,D2+即Ni2+。要写出Ni2+价层电子排布图,首先 得知道Ni2+核外电子排布式。很多学生想当然地利用原子核外电子排布的知识,认为镍原子核外电子先4s 后排3d,故原子在失电子时应先失3d电子后失4s电 子,即Ni2+的核外电子排布式应为[Ar]3d64s2。
镍原子变为镍离子究竟先失去哪个电子?查阅了高等教育出版社《面向21世纪课程教材•无机化学》(上册),书中明确提出:无论是基态电中性原子还是正离子的核外电子排布,笼统地讲,仍然可以归结为能量最低原理,即保持整个原子的能量最低。稍具体地讲, 整个原子的能量取决于两个因素——原子核对电子的吸引力和电子之间的相斥力,这是两个相反的因素,经常是其中一个居主导地位,另一个居次要地位。当原子核对电子的吸引力居主导地位时,电子填人主量子数较低的轨道会使整个原子的能量较低。进一步讲,当核电 荷对电子的吸引力居主导地位时,电子填人比较弥散的 3d轨道可以使内层电子受原子核更大的吸引,从而引起 整个原子的能量下降;若电子填人4s轨道,因4s电子具 有比3d电子更大的穿透内层电子而被核吸引的能力 (钻穿效应),从而使内层电子更加扩展,结果整个原子 的能量反而升高了。反之,当电子的排斥力居主导时, 其他电子对4s电子的排斥力小于对3d电子的排斥力, 因此电子填人4s轨道。进一步讲,这也是由于4s电子 比3d电子具有更大的能力穿透其他电子进人离核较近 的区域而受到其他电子较小的排斥,相反,3d电子比较弥散,受到其他电子的排斥力较大(屏蔽效应)。综上所 述,可知在原子的电子填充顺序中,电子的相互作用能 往往起着重要作用,到了离子的电子排布中,核吸引作用能却成为支配性因素了。
总之,基态原子核外电子排布要遵循三个原则,即能量最低原理、保里不相容原理和洪特规则。然而,当 原子在失去电子变为离子时,离子的电子排布取决于电子从何轨道中失去,失去电子顺序和填充电子顺序并不是恰恰相反的。实验和理论都证明,原子轨道失电子的次序是np、ns、(n一l)d,(n一2)f,即最外层的np电子最 先失去,p电子失光后才失ns电子,以此类推。因此, Ni2+核外电子排布式为1s22s22p63s23p63d2或[Ar]3d8, 价层电子排布式为3d8。

【例2】(山西太原2012年模二第37题) MnO2是 碱锰电池材料中最普通的正极材料之一,在MnO2中加 人COTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1) 写出 基态Mn 原子 的 电 子排布式
元素 | Mn | Fe | |
电离能/ kj / mol | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较锰和铁两元素的I1、I2可知,气态Mn2+再失去 一个电子比气态Fe2+再失去一个电子难。对此,你的解释是________________ 。
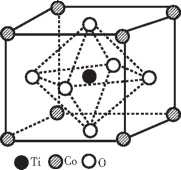
(2)在CoTiO3晶胞中(结构如图2所示),1个Ti原子,1 个Co原子周围距离最近的O原子数目分别为_____ 个、 个。
(3) 单质铝、石墨和二氧化钛按比例混合,高温下反应得到 的化合物均由两种元素组成,且 都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式为 。
(4) 叠氮酸(HN3)是一种弱酸,可部分电离出H+和 N3-。巳知N3-与CO2互为等电子体,则N3-的空间构型为_____ ,其中心原子的杂化轨道类型是_____ 。叠氮化物能与Co3+形成配合物,则[Co(N3) (NH3 )5]SO4中 配体是 ,钴的配位数是 。
解析:Mn2+、Mn3+核外电子排布式分别为:[Ar]3d5、[Ar]3d4,由Mn2+转化为Mn3+时,3d能级由稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+、Fe3+核外电子排布式分别为:[Ar] 3d6、 [Ar]3d5,由Fe2+转化为Fe3+时,3d能级由不稳定的3d6 状态变为稳定的3d5半充满状态,需要的能量相对要少。
答案:(1)3d54s2 ; Mn2+的3d轨道电子排布为半充满状态,较稳定。
(2)6;12。
(3) 4Al+3TiO2+3C  2Al2O3+3TiC
2Al2O3+3TiC
(4)直线型;sp;N3-、NH3

- 全部评论(0)
