在化学平衡计算中,恒温恒容与恒温恒压两个限制条件常常是重要的解题依据,恒温恒容的平衡体系中气体的物质的量之比等于气体的压强比,恒温恒压的平衡体系中气体的物质的量之比等于气体的体积比,不注意这两个条件限制的区别,解题时容易出错。尤其是密闭容器体积可变不一定都属于恒温恒压的条件,会造成解题更为复杂,要引起足够的重视。
一、定性问题定量解决
例1.甲醇是制备工业乙酸的原料,目前世界上一半以上的乙酸都采用甲醇与CO气体反应来制备。某实验小组在一个恒压密闭容器中加入0.20mol CH3OH和0.22mol CO气体,发生反应:CH3OH(g)+CO(g) CH3COOH(l),一定温度下达到平衡后测得甲醇的转化率为60%,容器体积为2L;维持温度不变,往上述达到平衡的恒压容器中,再在瞬间通入0.12mol CH3OH和0.06mol CO和混合气体,平衡的移动方向为 (填“向左”或“向右”或“不移动”),理由是 。
CH3COOH(l),一定温度下达到平衡后测得甲醇的转化率为60%,容器体积为2L;维持温度不变,往上述达到平衡的恒压容器中,再在瞬间通入0.12mol CH3OH和0.06mol CO和混合气体,平衡的移动方向为 (填“向左”或“向右”或“不移动”),理由是 。
错解剖析:平衡向右移动是普遍性的错误。错因:只考虑增加反应物,平衡一定右移,忽视了增加反应物的量在恒压密闭容器中反应物浓度不一定增大,故平衡不一定移动。
正确思维:在恒压密闭容器中,再增加CH3OH和CO的量,要分析容器体积是否发生变化,如果容器体积发生变化,所增加的反应物其浓度有否变化。实际上此题应计算并比较K与Qc的关系,然后再确定平衡移向。由甲醇的转化率为60%,求得平衡n(CH3OH)=0.08mol,n(CO)=0.1mol,n(总)= 0.18mol,容器体积为2L,两种气体(CH3COOH为纯液体平衡浓度为1)的平衡浓度依次为0.04mol·L-1、0.05mol·L-1,代入K=1/[c(CH3OH)×c(CO)],可求得K=500。再增加CH3OH和CO的量共为0.18mol,总物质的量为原平衡体系的2倍,故容器体积为4L。此时n(CH3OH)=0.2mol,n(CO)=0.16mol,两种气体浓度依次为0.05mol·L-1、0.04mol·L-1,代入Qc=1/[c(CH3OH)×c(CO)],可求得Qc=500。Qc=K,平衡不移动。
二、定量问题定量解决
例2.甲醇是一种重要的可再生能源。通过下列反应可以制备甲醇:CO(g)+2H2(g) CH3OH(g)。在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为10 L。如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积为
CH3OH(g)。在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为10 L。如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积为
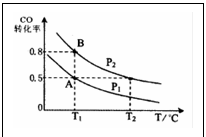
A.7 L B.2L C.14/3L D.无法计算
错解剖析:根据平衡状态A的CO转化率为50%,可得达平衡时气体总物质的量为20mol,而平衡状态B的CO转化率为80%,可得达平衡时气体总物质的量为14mol,利用气体的物质的量之比等于气体的体积比推知20mol∶14mol=10 L∶V,V=7L。其错因是气体的物质的量之比等于体积比的前提条件是同温同压,起始状态A与B的压强相同,但由图示知平衡状态A与B的压强不同,故此推理不正确。根据平衡状态B的CO转化率为80%,可得达平衡时气体总物质的量为14mol,利用气体的物质的量之比等于气体的体积比30mol∶14mol==10 L∶V,V=14/3L。其错因是平衡状态A与B的压强不同,且30mol 混合气体是起始的总物质的量与平衡状态B混合气体的总物质的量不能成正比关系,故选项C错。不知利用温度不变时平衡常数K不变的条件求解,只好误选D。
正确思维:平衡状态A的CO转化率为50%,可得平衡时三种气体的物质的量分别为n(CO)=5mol,n(H2)=10mol,n(CH3OH)=5mol,其平衡浓度依次为0.5mol·L-1、1mol·L-1、0.5mol·L-1,代入K==c(CH3OH)/[c(CO)·c2(H2)],可求得K=1。平衡状态B的CO转化率为80%,可得达平衡时三种气体的物质的量分别为n(CO)=2mol,n(H2)=4mol,n(CH3OH)=8mol,设在平衡状态B时容器体积为VL,则三种气体的平衡浓度依次为2/Vmol·L-1、4/Vmol·L-1、8/Vmol·L-1,由于A与B的温度均为T1,平衡常数K不变,代入K表达式可求得V=2。正确答案为B。
巩固训练:
1.在体积可变的恒压密闭容器中充入一定量的CO2与足量的碳让其发生反应C(s)+CO2(g) 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
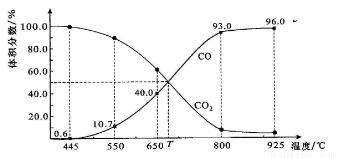
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,ʋ正、ʋ逆均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
2.如图所示,A是由易导热材料制成的体积不变的密闭容器,B是一耐化学腐蚀且易于传热的体积可变的透明气囊(体积改变过程中囊体弹力改变忽略不计)。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
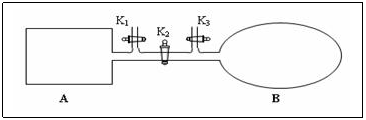
①B中可通过_________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5molN2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则反应速V(NO2)等于______________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
参考答案:
1.B
2.①气囊不再变小或颜色不再变化时(表示各物质的浓度不变)②变小
③0.4/at(mol·L-1·s-1)④0.7aL
 CH3COOH(l),一定温度下达到平衡后测得甲醇的转化率为60%,容器体积为2L;维持温度不变,往上述达到平衡的恒压容器中,再在瞬间通入0.12mol CH3OH和0.06mol CO和混合气体,平衡的移动方向为
CH3COOH(l),一定温度下达到平衡后测得甲醇的转化率为60%,容器体积为2L;维持温度不变,往上述达到平衡的恒压容器中,再在瞬间通入0.12mol CH3OH和0.06mol CO和混合气体,平衡的移动方向为  CH3OH(g)。在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为10 L。如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积为
CH3OH(g)。在一容积可变的密闭容器中充入10 mol CO 和20 mol H2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为10 L。如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积为
 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

 N2O4已经达到平衡。
N2O4已经达到平衡。
