“三段式法”解化学平衡计算题
时间:2022-12-14 09:49 来源:未知 作者:古盛兰 点击: 次 所属专题: 平衡计算 三段式计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在化学平衡的计算中,常常要计算反应物的转化率、各组分的转化浓度、转化的物质的量、平衡浓度、平衡时物质的量等。若在反应方程式下用“三段式”列出各物质的开始、转化、平衡的量,能理顺关系,找出已知与未知的关系,对正确分析和解决问题有很大帮助。
[例1] 在一定条件下已测得反应2CO2 2CO+O2,其平衡体系的平均相对分子质量为M,则在此条件下二氧化碳的分解率为 。
2CO+O2,其平衡体系的平均相对分子质量为M,则在此条件下二氧化碳的分解率为 。
[分析]
假设起始二氧化碳的物质的量为2mol,分解率为x
2 CO2  2 CO + O2
2 CO + O2
开始物质的量 2mol 0 0
转化的物质的量 2x 2x x
平衡物质的量 2—2x 2x x
根据质量守恒定律,反应前后气体的总质量为88g,反应后气体的总的物质的量为:(2—2x)+2x+x =2—x
由摩尔质量的定义得:M=88g/(2—x)mol
所以 x=(88—2M)/M
[例2] 把3molA和2.5molB混合,充入2L密闭容器中,发生下列反应:3A(g)+B(g) xC(g)+2D(g),经5秒钟反应达到平衡,生成1mol D,并测得C的平均反应速率为0.1mol·L-1·s-1,则此反应中B的转化率为 ,C的化学计量数x为 ,A的平衡浓度为 。
xC(g)+2D(g),经5秒钟反应达到平衡,生成1mol D,并测得C的平均反应速率为0.1mol·L-1·s-1,则此反应中B的转化率为 ,C的化学计量数x为 ,A的平衡浓度为 。
[分析]
在反应方程式下用“三段式”列出各物质的开始、转化、平衡的量
3A(g)+B(g) xC(g)+2D(g)
xC(g)+2D(g)
开始物质的量 3mol 2.5mol 0 0
转化的物质的量 1.5mol 0.5 mol 1mol
反应速率 0.1mol·L-1·s-1
平衡时物质的量 1.5mol 2 mol 1mol 1 mol
由D的生成量,根据方程式可计算出A、B的转化量分别为1.5mol 、0.5mol。所以,B的转化率为0.5/2.5=20%。
由题意,D的反应速率为 1mol/(2L·5s)=0.1mol·L-1·s-1
根据C、D的平均反应速率之比等于化学计量数比,可得x=2。
根据平衡时A的物质的量,A的平衡浓度为1.5mol/2L=0.75mol/L。
[例3] 在一定条件下,将N2、H2混合气体100mL通人密闭容器内,达到平衡时,容器内的压强比反应前减小1/5,有测得此时混合气体的平均相对分子质量为9。试求:
⑴原混合气中N2、H2各多少毫升?
⑵H2的转化率是多少?
[分析]
根据N2与H2反应的特点,4体积反应生成2体积,总体积减少2体积,减少的体积等于生成的氨的体积。根据阿伏加德罗定律,反应前后压强比等于体积比,压强减少1/5,体积减少100mL的1/5,即减少20mL。
设开始N2、H2的体积分别为a、b,在反应方程式下用“三段式”列出各物质的开始、转化、平衡的量
N2 + 3H2  2NH3
2NH3
开始 a b 0
转化 x 3x 2x
平衡 a—x b—3x 2x
依题意有
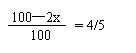
x=10mL
又体积与物质的量成正比。所以有:
①a+b=100
②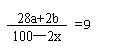
解①②得:
a=20mL,b=80mL 。
即开始N2、H2的体积分别为20mL、80mL。
氢气的转化率为:
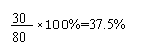
以上几例可以看出,只要用“三段式”理顺反应过程中的各物质的各量间的关系,复杂的问题就能迎刃而解。

- 全部评论(0)
