Cl2分子中的Cl-Cl键能为什么比F2中F-F键能高?
时间:2017-04-18 15:46 来源:未知 作者:王利平 点击: 次 所属专题: 键能 氯气 氟气
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氯分子中Cl-Cl键的键能是239KJ·mol-1。为什么Cl-Cl键能比F-F键能大呢?氟位于第二期,而氯位于第三周期,它具有空的3d轨道。当利用这种空的d轨道作为电子对接受体时,就能产生新的化学键。
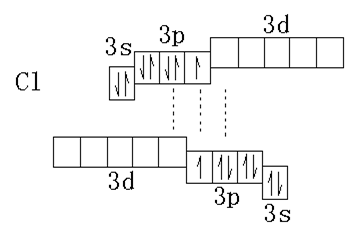
也就是说在Cl2分子中既有靠未成对电子形成的共价键,又有靠孤对电子和空轨道形成的配位键。每个Cl原子同时既是电子对的给予体,也是电子对的接受体,其间的键可以表示为
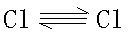
这就是氯分子中键能比氟分子中键能高的原因。也就是说氯分子中存在着多重键,而氟分子中不可能形成多重键,否则,氟分子应该比氯分子更稳定些。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
(1173124270) 评论 href="/plus/view.php?aid=16287">Cl2分子中的Cl-Cl键能为:高中知识怎么解释?
还没有评论,快来抢沙发吧!
