为什么SiCl4极易水解,而CCl4却不易水解?
时间:2020-11-17 17:38 来源:未知 作者:化学自习室 点击: 次 所属专题: 非盐水解反应 四氯化碳
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
室温下,SiCl4 遇水会强 烈水解:SiCl4+4H2O=H4SiO4+4HCl。而CCl4 却不容易水解,故实验室可用CCl4 萃取溴水中的溴单质。为什么?
共价型化合物水解的必要条件是电正性原子要有空轨道。硅原子不仅有可供成键的 3s 和 3p轨道,而且还有空的 3d 轨道。当 SiCl4 遇到水分子时,具有空轨道的硅原子可接受水分子中 O 原子提供的孤对电子,形成配位键,同时使原有的Si-Cl 键消弱、断裂,所以 SiCl4 遇水就会强烈水解。
碳原子的 L 层只有 2s、2p 轨道,即电正性的碳原子没有空轨道,水分子的 O 原子无法将电子对给予 C 原子,所以 CCl4 不容易水解。
从卤代烃水解角度看,CCl4 不易水解有两大原因:CCl4 中的 C-Cl 键键能较大,不易断裂;虽然 H2O 分子有亲核性,但其亲核能力比 Cl- 弱。
所以要使 CCl4 水解,就必须提高试剂的亲核性以及温度。如在热 NaOH 溶液中,CCl4 就能水解:
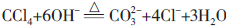
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
