SOCl2的结构、制备和性质的考查
时间:2019-05-20 09:33 来源:未知 作者:化学自习室 点击: 次 所属专题: 氯化亚砜
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、化合物 SOCl2是一种液态化合物,沸点 77℃,实验室中可用 CaSO3和 PCl5混合共热制备。在工业生产和化学实验中,SOCl2是一种重要的化学试剂。在盛有 10mL 水的锥形瓶中小心地滴加 8~10 滴 SOCl2,可观察到反应剧烈发生,液面上有白雾形成,并逸出刺激性气味的气体。
1. 指出SOCl2的分子构型。
2. 写出CaSO3与 PCl5共热制备SOCl2的化学方程式。
3. 写出 SOCl2与H2O完全反应的化学方程式。
4. 设计一些简单实验来验证你写出的化学方程式(3)是正确的。(只需给出实验原理和现象,无须描述实验仪器和操作)。
5. 工业上往往用 ZnCl2·3H2O和 SOCl2混合共热来制取无水 ZnCl2。说明该种制法可行性的原因。
6. SOCl2在有机化学中作氯化剂。写出苯甲酸和 SOCl2反应的化学方程式。
7. 为了使(6)生成的有机物与混溶在其中的过量的 SOCl2分离,可以采用的分离操作是什么?
第一题(8 分)
1.三角锥(0.5 分)
2. CaSO3+2PCl5=CaCl2+2POCl3+SOCl2(1分)
3. SOCl2+H2O=SO2+2HCl(1分)
4. 向水解产物的水溶液中通入H2S气体有淡黄色(硫磺)沉淀析出(2H2S+SO2=3S↓+2HO);向另一份水解产物的水溶液中加入AgNO3溶液有白色(AgCl)沉淀析出(Ag++Cl-=AgCl↓)(2分)
5. 直接加热ZnCl·3HO,由于Zn2+水解得不到ZnCl2。SOCl2与晶体ZnCl2·3H2O混合共热时,SOCl2优先于 Zn2+与水结合生成 HCl,减少了 Zn2+与 H2O 反应的程度,同时生成的HCl 抑制Zn2+水解,最终得到无水ZnCl2。(1.5 分)
6.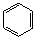 -COOH+SOCl2→
-COOH+SOCl2→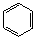 -COCl2+SO2↑+HCl↑(1分)
-COCl2+SO2↑+HCl↑(1分)
7.蒸馏(1分)
二、磺酰氯(SO2Cl2)和亚硫酰氯(SOCl2)均是实验室常见试剂。
已知:SO2Cl2(g) SO2(g)+Cl2(g) K1 ΔH=aKJ·mol-1 (Ⅰ)
SO2(g)+Cl2(g) K1 ΔH=aKJ·mol-1 (Ⅰ)
SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g) K2 ΔH=bkJ·mol-1 (Ⅱ)
2SOCl2(g) K2 ΔH=bkJ·mol-1 (Ⅱ)
(1)反应:SO2Cl2(g)+SCl2(g) 2SOCl2(g)的平衡常数K=________(用K1、K2表示),该反应ΔH=______(用a、b表示)KJ·mol-1。
2SOCl2(g)的平衡常数K=________(用K1、K2表示),该反应ΔH=______(用a、b表示)KJ·mol-1。
(2)为研究不同条件对反应(Ⅰ)的影响,将13.5 g SO2Cl2充入2.0 L 的烧瓶中,在101 KPa、375 K条件下,10 min 后达到平衡,平衡时SO2Cl2的转化率为0.80,则0~10 min内Cl2的平均反应速率为_________,平衡时容器内压强为________KPa,该温度下的平衡常数为________;若要减小SO2Cl2的转化率,除改变温度外,还可采取的措施是___________(列举一种)。
(3)磺酰氯对眼和上呼吸道黏膜有强烈的刺激性,发生泄漏时,实验室可用足量NaOH固体吸收,发生反应的化学方程式为______;亚硫酰氯遇水的化学方程式:___________。
(4)将一定量的Cl2用稀NaOH溶液吸收,若恰好完全反应,则溶液中各离子浓度由大到小的顺序为______________;已知常温下,次氯酸的Ka=2.5×10-8,则该温度下NaClO水解反应的平衡常数Kb=____。
第二题
答案 (1)K1·K2 a+b
(2)0·004 mol·L-1·min-1 181.8 0.16 增大压强(或缩小容器体积)
(3)SO2Cl2+4NaOH===Na2SO4+2NaCl+2H2O SOCl2+H2O===SO2↑+2HCl↑
(4)c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+) 4×10-7
解析 (1)反应SO2Cl2(g)+SCl2(g)==2SOCl2(g)可由反应(Ⅰ)、(Ⅱ)相加得到,故其平衡常数为两者之积,反应热为两者之和。
(2)生成Cl2的物质的量为0.08 mol,其浓度为0.04 mol·L-1,故Cl2的反应速率为0.004 mol·L-1·min-1;平衡时总物质的量为0.02 mol+0.08 mol+0.08 mol=0.18 mol,故平衡时压强为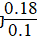 ×101 KPa=181.8 KPa;K=
×101 KPa=181.8 KPa;K=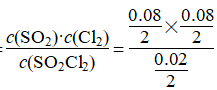 =0.16;若要减小转化率,可通过缩小容器体积即增大压强的方法。
=0.16;若要减小转化率,可通过缩小容器体积即增大压强的方法。
(3)SO2Cl2中硫为+6价,氯为-1价,氢氧化钠足量时生成硫酸盐和盐酸盐;SOCl2中硫为+4价,水解生成SO2及HCl。
(4)Cl2+2NaOH===NaCl+NaClO+H2O,显c(Na+)最大,考虑到ClO-水解显碱性,c(Cl-)>c(ClO-) c(OH-)>c(H+);HClO的电离常数与ClO-水解常数之积等于水的离子积,故Kb=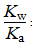 =4×10-7。
=4×10-7。
三、硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:
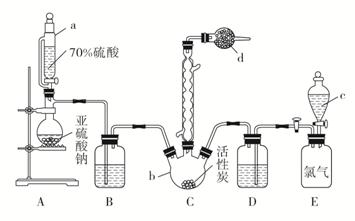
已知:
①SO2(g)+Cl2(g) SO2Cl2 ΔH=-97.3 KJ/mol
SO2Cl2 ΔH=-97.3 KJ/mol
②硫酰氯常温下为无色液体,熔点为-54.1 ℃,沸点为69.1 ℃,在潮湿空气中易“发烟”。
③100 ℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是_______________。
(2)仪器b的名称为____________。
(3)装置A中发生化学反应的离子方程式为_______________________。
(4)仪器D中盛放的试剂为________。
A.无水硫酸铜 B.无水氯化钙 C.碱石灰 D.五氧化二磷
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_______,分离这两种液态产物的方法是________。
(6)装置E为储气装置,用于提供氯气,则分液漏斗C中盛放的试剂为________。当装置E中排出氯气0.224 L(已折算成标准状况)时,最终得到1.08 g 纯净的硫酰氯,则硫酰氯的产率为______。长期存放的硫酰氯会发黄,其原因可能为________________。
第三题
答案 (1)平衡分液漏斗内外压强,便于液体顺利流下
(2)三颈烧瓶
(3)2H++SO32-===H2O+SO2↑
(4)C
(5)2ClSO3H SO2Cl2+H2SO4 蒸馏
SO2Cl2+H2SO4 蒸馏
(6)饱和食盐水 80% 硫酰氯中溶有其分解产生的氯气
解析 (1)仪器a为恒压分液漏斗,可以平衡分液漏斗内外气压,便于液体顺利流下。
(3)装置a中硫酸和亚硫酸钠反应生成二氧化硫气体,故离子方程式为2H++SO===H2O+SO2↑。
(4)装置C中产生硫酰氯,硫酰氯在潮湿空气中“发烟”,SO2和Cl2有毒,不能直接排放到大气中,要用碱石灰防止空气中的水分进入装置C,并吸收SO2和Cl2,故仪器D中盛放的试剂为碱石灰。
(5)氯磺酸(ClSO3H)加热分解,制得硫酰氯的化学方程式为2ClSO3H SO2Cl2+H2SO4,硫酰氯沸点较低,硫酸的沸点较高,故分离硫酰氯和硫酸用蒸馏。
SO2Cl2+H2SO4,硫酰氯沸点较低,硫酸的沸点较高,故分离硫酰氯和硫酸用蒸馏。
(6)氯气在饱和食盐水中溶解度很小,故分液漏斗C中盛放的试剂为饱和食盐水。氯气的物质的量为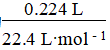 =0.01 mol,
=0.01 mol,
由方程式可n(SO2Cl2)==n(Cl2)=0.01 mol,故理论上生成SO2Cl2的质量为0.01 mol×135 g/mol=1.35 g,故其产率为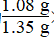 ×100%=80%;长时间存放硫酰氯易分解,生成二氧化硫和氯气,生成的氯气会溶解在硫酰氯中,从而使硫酰氯发黄。
×100%=80%;长时间存放硫酰氯易分解,生成二氧化硫和氯气,生成的氯气会溶解在硫酰氯中,从而使硫酰氯发黄。

- 全部评论(0)
