氮的氧化物和O2、H2O混合反应的计算方法
时间:2020-01-31 10:45 来源:未知 作者:化学自习室 点击: 次 所属专题: 氮氧化物计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、方法介绍
1.关系式法
(1)NO和O2的混合气体通入水中
由2NO+O2===2NO2和3NO2+H2O===2HNO3+NO得总反应为4NO+3O2+2H2O===4HNO3。

(2)NO2和O2的混合气体通入水中
由3NO2+H2O===2HNO3+NO和2NO+O2===2NO2得总反应为4NO2+O2+2H2O===4HNO3。
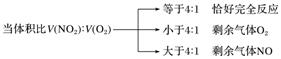
(3)NO、NO2和O2三种混合气体通入水中
先按3NO2+H2O===2HNO3+NO计算出生成NO的体积,再加上原来混合气体中NO体积,再按(1)计算。
2.电子守恒法
NOx转化为硝酸时失去电子,如果是NOx与O2的混合气体,则反应中O2得到的电子数与NOx失去的电子数相等。
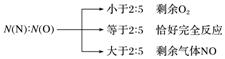
4NO2+O2和4NO+3O2从组成上均相当于2N2O5,都与N2O5+H2O===2HNO3等效;当NO、NO2、O2的混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。
二、应用
1.(2018·广州期末)有一充有20mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12mL 无色气体,则原混合气体中NO和NO2体积比为(气体体积均在相同状况下测得)( )
A.2∶3 B.3∶2 C.1∶4 D.4∶1
答案 A
解析 二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮和水不反应,所以,剩余的气体为一氧化氮,设混合气体中二氧化氮的体积为V,则:
3NO2+H2O===2HNO3+NO 气体体积减少
3 1 2
V 20 mL-12 mL=8 mL
所以V=![]() =12 mL,即二氧化氮的体积为12 mL,则原混合气体中一氧化氮的体积为20 mL-12 mL=8 mL,则原混合气体中NO和NO2体积比为8 mL∶12 mL=2∶3。
=12 mL,即二氧化氮的体积为12 mL,则原混合气体中一氧化氮的体积为20 mL-12 mL=8 mL,则原混合气体中NO和NO2体积比为8 mL∶12 mL=2∶3。
2.将盛有12mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL 无色气体,则原混合气体中O2的体积和剩余的2mL 气体分别是( )
A.1.2mL,NO B.2.4mL,O2 C.3.5mL,O2 D.4mL,NO
答案 A
解析 解题依据的化学方程式:
4NO2+O2+2H2O===4HNO3;
3NO2+H2O===2HNO3+NO。
设O2的体积为x,剩余的气体有两种可能:
①若剩O2,则V(剩)=x-![]() ×(12 mL-x)=2 mL,
×(12 mL-x)=2 mL,
解得x=4 mL,B、C两项均不正确;
②若剩NO,则V(剩)=![]() ×[(12 mL-x)-4x]=2 mL,
×[(12 mL-x)-4x]=2 mL,
解得x=1.2 mL,D项不正确、A项正确。
3.将充有m mLNO和n mLNO2的量筒倒立于水槽中,然后通入m mLO2,若m<n,则充分反应后,量筒内剩余的气体体积为( )
A.3(m-n) mL B.(m+n) mL C.(m-n) mL D.![]() mL
mL
答案 D
解析 发生反应4NO2+O2+2H2O===4HNO3,4NO+3O2+2H2O===4HNO3,故NO与NO2按1∶1混合的总反应为:NO+NO2+O2+H2O===2HNO3,
充有m mL NO和n mL NO2的量筒倒立于水槽中,然后通入m mL O2,由于m<n,故按总反应进行,NO2有剩余,剩余NO2的体积为n mL-mmL=(n-m) mL,再发生3NO2+H2O===2HNO3+NO,故生成NO的体积为![]() (n-m) mL。
(n-m) mL。

- 全部评论(0)
