浅议键能与键长的关系
时间:2019-06-05 09:41 来源:未知 作者:时亚中 点击:次 所属专题: 键能
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
人教版《选修3》第二章第一节关于键能与键长是这样描述的:键能是气态基态原子形成1 mol 化学键释放的最低能量,键长是形成共价键的两个原子之间的核间距。键长越短,往往键能越大,表明共价键越稳定。但目前通过理论性的研究和计算发现,并非所有化合物中的化学键都存在着键长越短而键能越大的关系,笔者就这个问题谈谈自己的认识。
问题1:Si-F键的键长与键能为什么均大于C-F键的键长与键能?

由表1可以看出,第ⅣA族元素C和Si的卤化物,键长越长,键能也越大。如第三周期Si-F的键长、键能均大于第二周期的C-F。
众所周知,卤化硅中Si是缺电子原子,可以看作是Lewis酸;而卤化硅中的卤素原子周围则有3对孤对电子,可以看作是Lewis碱,这样卤化硅本身便形成了一个Lewis酸碱对。这种卤原子给电子,硅原子接受电子的效应大大增强了硅卤键的键能。另一方面,从成键的角度来看,经过计算,Si的3d轨道与卤原子孤对电子所占的轨道能形成一定有效重叠,这使得硅卤键的电子云密度增大,键的强度增加。
问题2: O―O的键长与键能为什么均小于第三周期S―S的键长与键能?
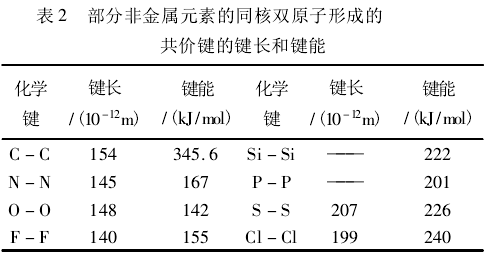
根据表2中的数据,将同主族元素的同核双原子形成的共价键的键能和键长进行分析比较可以看出:第二周期O-O的键长、键能均小于第三周期的S-S,F-F的键长、键能均小于第三周期的Cl-Cl。此外,第二周期C、N、O、F的同核双原子形成的共价键键能并没有随着键长的减小而有规律地增大,反而有下降的趋势。
经过分析及推测可知,第二周期的元素原子半径小,参与成键的原子中又有孤对电子,其排斥作用抵消了部分键能,所以单键键能会反常地小。也就是说孤对电子之间不可忽略的斥力导致了键长与键能关系的反常性。而第三周期Si、P、S、Cl的同核双原子键能的变化较有规律,因为电子层数的增多,使得Si、P、S、Cl的原子半径比上一周期同族元素相应增加,根据库仑定律可知,原子半径的增大削弱了核外孤对电子间的斥力作用,使得键长(即核间距)成为影响键能的主要因素。
问题3: C=C的键长与键能为什么均大于N=N的键长与键能?
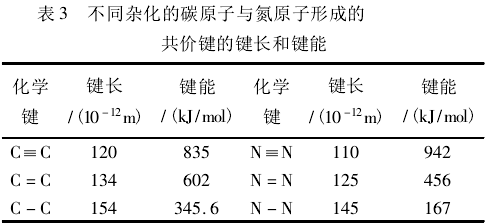
C-C与N-N的反常性在上一问题中得到了合理的解释,若将此结论作合理地外推,那么C=C与N=N、C≡C与N≡N也将遵循上述规律,但由表3中实验数据表明:只有C=C与N=N存在反常现象。
究其原因,N-N、N=N中N分别是sp3和sp2杂化,孤对电子靠得近,它们之间的斥力作用对键能的影响不可忽略;N≡N中N是sp杂化,孤对电子离得比较远,导致孤对电子的排斥作用对键能的影响很小。
问题4: N-H的键长与键能为什么均小于C-H的键长与键能?
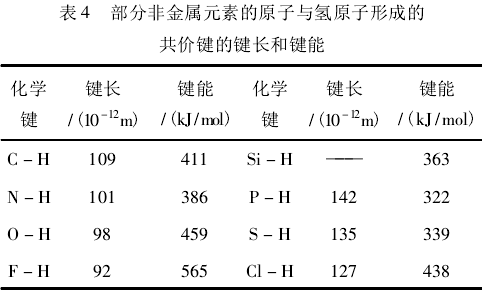
同一主族的P区非金属元素与H形成的共价键的键能都是有规律地自上而下依次递减,没有出现反常(见表4)。这是因为H没有孤对电子,Ⅳa族元素原子自身成键时,4个价电子也全部用于成键,因此,孤对电子的排斥作用对键能的影响很小,主要是核间距的影响。
问题5: Si-O的键长与键能为什么均大于C-O的键长与键能?

看见表5所列数据,有些人可能会认为是O的p轨道与Si的3d轨道共轭产生电子的离域,进而获得额外的离域能。看起来很有道理,但却忘记了SiO2成键特点。查相关数据SiO2的标准熵41.84 J/(mol・K),实际上SiO2在室温下是原子晶体而含有C-O的物质在室温下几乎都为分子,所以想要把SiO2变成硅和氧原子要额外的能量来破坏它的晶格,也就是硅的氧化物比碳的氧化物要有额外的点阵能。
综上所述,影响键长和键能的因素有很多,例如原子半径、原子核间距离、孤对电子之间的排斥力、反馈键等,在实际的分子中,由于受共轭效应、空间阻碍效应和相邻基团电负性的影响,同一种化学键键长还有一定差异。因此在讨论问题时必须视具体情况进行分析。

- 全部评论(0)
