关于电极的命名解读
时间:2021-12-21 11:39 来源:未知 作者:化学自习室 点击: 次 所属专题: 正负与阴阳
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
关于电极的命名,目前极不统一,容易产生混淆,给教学工作增添麻烦。下面就目前国内多数教科书的习惯规定及有关间题加以说明。
关于电化学装置(原电池和电解池)中电极命名法的习惯规定:
1.电化学装置的两个电极,电势高者称为正极,电势低者称为负极.
电流的方向在外电路是从正极流向负极(电于流动的方向是从负极流向正极).从电极发生反应的类型看,负极发生氧化反应,正极发生还原反应,这种规定多用于原电池.
2.电化学装置的两个电极,凡是发生氧化反应的电极称为阳极,凡是发生还原反应的电极称为阴极。
这种规定对电解池和原电池都适用,多用于电解池.
但在不少场合下,不论对原电池或电解池都需要既用正、负极,又用阴、阳极,使初学者感到困难.如果搞清电化学装置的正、负极和阴、阳极的对应关系,抓住电极反应的共同特征去理解运用,间题并不难解决。

由上表不难看出,以阴、阳极命名原电池和电解池的两个电极,在电极上发生反应的类型是相同的。
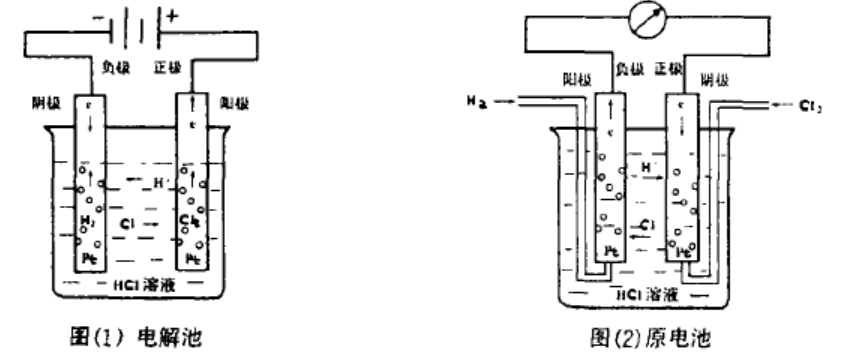
例如:图(1)是电解池,它是由与外电源相连接的两个铂片插入盐酸水溶液而构成的.溶液中的H+和Cl-在电场力的作用下,分别向电源的负极和正极迁移,从而造成电流在溶液中通过。当外电压足够大时,电极反应和电池反应如下:
阴极发生还原发生(阴极、负极) 2H++2e-=H2
阳极发生氧化反应(阳极、正极) 2Cl--2e-=Cl2
电池反应(阴、阳极反应相加) 2H++2Cl-==H2+Cl2
例如:图(2)是一原电池,它是在盛有盐酸水溶液的容器中插入两个铂片,对其分别通入氢气和氯气而构成的电池。在此电池装置中,铂片起导电和气体载体的作用,本身不发生化学变化。这样就构成了H2电极和Cl2电极。电极反应和电池反应如下:
H2电极发生氧化反应(负极、阳极) H2-2e-==2H+
Cl2电极发生还原反应(正极、阴极) Cl2+2e-==2Cl-
电极反应(两电极反应相加) H2+Cl2==2H++2Cl-
应当注意的问题,
一是对于原电池,无论是否将两极接通,即外电路无论是否有电流发生,我们总可以根据电极电势的高低判断出电极的正或负极;而对于电解池则只有与外电源接通时才能确定其阴、阳极,即与外电源正极相连接的电极为阳极,与负极相连接的电极为阴极.
二是从电池反应来看,在原电池中发生的反应是自发的,反应中的化学能通过原电池转变成电能,使其具有对外作电功的能力;而在电解池中靠消耗外电源的电能,通过电解池迫使电池反应进行,则使电能转变成化学能。

因此,根据电池反应的自发与否,可以判断哪是原电池(或电解池)。

- 全部评论(0)
