电化学装置两极的判别
时间:2021-12-21 11:28 来源: 作者:张修鹏 点击: 次 所属专题: 正负与阴阳
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电化学装置包括电解池和原电池。一般习惯上对原电池用正极和负极命名,对电解池常用阴极和阳极命名。但在有的场合下对两池的两极同时用正、负、阴、阳来命名。如何统一对照命名,可用“多负少正,氧阳还阴”八字作为判据。
1.两极板相对电子多的极(即电极电位低)称为负极;相对电子少的极(即电极电位高)称为正级。即“多负少正。”或“低负高正”。
2.在电化学装置两极中,凡有氧化反应发生者称为阳极;凡有还原反应发生者称为阴极。即“氧阳还阴”。
3.电解池只有与外直流电源接通后,才能定其阴、阳极。和外电源正级(缺电子极)相连的是阳极,和外电源负极(电子富饶之极)相连的是阴极。在电解池中,溶液中的阳离子奔向阴极放电,阳离子群依其放电顺序而获得电源负极的电子而发生还原反应,故而负极(电源)对应于阴极(电解池中的电极)。可见,这个阴极实际只起了导体作用,故也就是说,发生的还原反应是指的溶液中的阳离子得电子而被还原。
溶液中的阴离子奔向阳极:
(1)当阳极是惰性材料制做时(简称“惰性电极”),溶液中的阴离子奔向阳极放电,阴离子群依其放电顺序失电子而发生氧化反应(此电极也只起导体作用),故而电源的正极对应于电解池中的阳极。
(2)当阳极不是惰性材料(如石墨,Pt),而是较活泼的金属制做时,这时,电源的正极(电子贫穷之极),不要溶液中阴离子放电,而直取该极板(金属)的电子,此时该极自身失电子(电子流向电源正极)被氧化,这时才是电极自身发生了氧化反应(被氧化)。
小结:两池化学原理,可从下图一目了然。
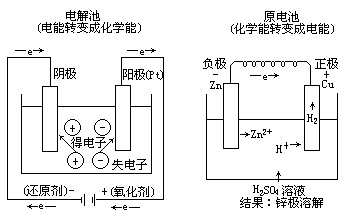
注:物理学上电流的流向是就正电荷而言的,本图示是指电子流向(内电路是阴离子流向)为其方向,二者虽然相反,实质是不矛盾的。
(责任编辑:)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
