金刚石、二氧化硅、石墨晶体结构及性质难点解析
时间:2019-08-02 16:03 来源:未知 作者:董正转 点击: 次 所属专题: 金刚石晶胞 二氧化硅晶胞 石墨
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
《晶体结构与化学性质》是人教版《选修3》的第三章内容,在高考中以选做题的形式呈现。在近几年的新课标全国卷高考考试说明中对晶体认识有如下要求:
1.理解金属键的含义,能用金属键理论解释金属的一些物理性质。
2.了解金属晶体常见的堆积方式。
3.了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
4.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别。
5.能根据晶胞确定晶体的组成并进行相关的计算。
6.了解晶格能的概念及其对离子晶体性质的影响。
因此对晶体结构有一个比较细致的认识,是非常必要的。然而通过教学发现,学生在晶体学习中表现出较弱的微粒观,学生难以从微观粒子(原子、离子)去认识晶体的微观结构以及其微观结构对晶体宏观性质的影响。一方面原因是学生自身的微观想象能力的欠缺,另一方面可能是教师在教学过程对晶体结构的分析不够微观化。
为帮助学生更好的从微观的角度去认识晶体结构,本文将结合图形解析的方式对高考常考的原子晶体中两种典型代表:金刚石晶体和二氧化硅晶体,混合型晶体石墨晶体来分析其结构特点以及结构对晶体某些性质的影响。
1、金刚石晶体
金刚石晶体是全由碳原子通过共价键结合形成的晶体,是一种原子晶体,其结构为三维的共价键网状结构,故金刚石晶体也称共价晶体。在高考中,金刚石晶体的晶胞结构常被直接拿来考查或间接考查与金刚石具有相似晶胞结构的晶体。
1.1金刚石晶体的空间三维网状结构
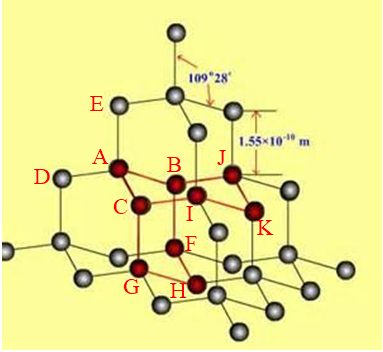
图1‑1
在价键理论中,碳(C)四价稳定。如图1-1所示,在金刚石晶体中,每个碳原子则都采取sp3杂化方式与周围的4个碳原子形成4个共价单键,这5个碳原子在空间的相对位置就如同甲烷的5个原子(1个碳原子、4个氢原子)在空间的相对位置,为正四面体结构,碳碳键键角为109°28′。这种小的正四面体结构在空间的延伸则形成金刚石的三维空间网状结构。
正是由于金刚石晶体是碳原子之间通过共价键结合而成,而碳碳键(C—C)的键长很短(154pm),键能很大(347.7KJ/mol),从而使得金刚石晶体的熔点很高(>3500℃),硬度很大。原子晶体都是通过共价键形成的晶体,因此也都有着类似金刚石的高硬度、高熔点的物理特性。
1.2金刚石晶体碳原子成环和碳原子与碳碳键比分析
1.2.1金刚石中碳原子成环分析
金刚石晶体结构中,结合图1-1可以看出,碳原子之间形成了许多的环状结构。根据成环的碳原子数目可以分为六元环(6个碳原子形成的环,下同),十元环等等。其中最简单的也就属六元环,六元环也即金刚石晶体结构中最小的环。2015年高考全国卷中曾经考查过金刚石中每个碳原子被多少个六元环所共用。不少学生对每个碳原子被12个六元环所共用表示很难理解。下面本文将结合图形,利用数学知识说明每个碳原子被12个六元环所共用。
如图1-1所示,任意选取一碳原子为A原子,则A原子分别与周围的B、C、D、E原子形成了4个共价键。分析AB、AC共价键,AB键和AC键同时只被两个六元环(六元环ABJKIC和六元环ABFHGC)。换成AB、AE或AE、AD,其结果都是这两个共价键被两个六元环所共用。换而言之,A原子所形成的四个共价键中,任意取两个共价键,这两个共价键都将被两个六元环所共用。在A所形成的4个共价键中任意选取两个共价键,有![]() =6种选法,每一种选法中A碳原子被两个六元环共用,则在6种选法中,A共被12个六元环所共用,也就是
=6种选法,每一种选法中A碳原子被两个六元环共用,则在6种选法中,A共被12个六元环所共用,也就是![]() =12个六元环。
=12个六元环。
在上述分析中,碳原子A是任意选取的,所以金刚石中每个碳原子均被12个六元环所共用。
每个最小六元环中,尽管由6个碳原子形成,但由于每个碳原子被12个六元环所共用,因此每个碳原子独立属于这个六元环的成分为![]() ,也即每个六元环独立占有的碳原子数目为
,也即每个六元环独立占有的碳原子数目为![]() 个碳原子。
个碳原子。
1.2.2金刚石中碳原子与碳碳键比分析
金刚石是碳原子通过共价键形成的原子晶体,每个碳原子都形成4个共价键,那12g 金刚石中是否就含有4NA个共价键呢?这类问题也是高考考查中的一个重要方面。
金刚石晶体中,尽管每个碳原子是形成了4个共价键,但是每个共价键是被两个碳原子所共有,因此计算12g 金刚石中C—C键数目,不能简单认为是碳原子数目的4倍。
方法一:选取其中一个共价键为基础来分析,如图1—1中AB键
AB键是由A原子和b原子共同形成的,但是A原子和B原子都各自形成了4个共价键,那么A原子和B原子对Ab键的贡献都是![]() ,则有
,则有![]() ,也即在金刚石中碳原子数与碳碳键数之比 n(C) :n(C—C)=1:2,1mol 金刚石中碳碳键(C—C)的物质的量为:2mol。
,也即在金刚石中碳原子数与碳碳键数之比 n(C) :n(C—C)=1:2,1mol 金刚石中碳碳键(C—C)的物质的量为:2mol。
方法二:选取其中一个碳原子为基础来分析,如图1—1中A原子
A原子与周围的B、C、D、E原子形成4个共价键,但每一个共价键都是AB、AC、AD、AE共同拥有,也即,4个共价键中,每一个共价键只有一半是属于A原子,4个共价键的另一半分别属于B、C、D、E原子。换言之,A原子独立拥有的共价键为![]() 。一个碳原子独立占有的C—C键为2,也就是金刚石中碳原子数与碳碳键数之比 n(C) :n(C—C)=1:2,1mol 金刚石中碳碳键(C—C)的物质的量为:2mol。
。一个碳原子独立占有的C—C键为2,也就是金刚石中碳原子数与碳碳键数之比 n(C) :n(C—C)=1:2,1mol 金刚石中碳碳键(C—C)的物质的量为:2mol。
小结:金刚石晶体中,每个碳为sp3杂化,碳碳键键角为109°28′,最小环为六元环,每个碳原子被12个六元环所共有,每个最小环独立占有![]() 个碳原子,独立占有碳碳键1个,碳原子(C)数与碳碳键(C—C)数之比 n(C) :n(C—C)=1:2。
个碳原子,独立占有碳碳键1个,碳原子(C)数与碳碳键(C—C)数之比 n(C) :n(C—C)=1:2。
1.3金刚石晶体晶胞密度和空间利用率计算

图1‑2
金刚石晶胞中,共有8个碳原子。如图1-2,4个着色标记的球在晶胞体内,八个顶角共有![]() =1个碳原子,六个面共有
=1个碳原子,六个面共有![]() =3个碳原子,总共为8个碳原子。
=3个碳原子,总共为8个碳原子。
晶胞密度计算和空间利用率计算是常考的一个点。对常见基本的晶胞结构晶胞密度和空间利用率计算的掌握是解决其他晶体相关计算的基础。
计算晶胞密度和空间利用率的关键是找出晶胞边长与原子半径之间的关系。
方法一:几何法
如图1-2所示,先在金刚石晶胞中标出A、B、C、D、E四个碳原子,其中A点为左下角碳原子,B为底面底心上的碳原子,C左侧面面心碳原子,D为前面(面向我们这一面)面心位置,E为与A、B、C、D相连的碳原子,则碳原子A、B、C、D、E处于小立方体CFDGHAIB的顶点和体心位置,将小立方体CFDGHAIB取出,就得到如图“金刚石晶胞的1/8”
设晶胞边长为A,C—C键长为l,碳原子半径为r
则有:l=2r
![]()
![]()
AE= l=2r(晶体中,相邻原子之间尽可能紧密相切)
根据勾股定理:AO2+OE2=AE2
故有:![]() 解出:
解出:![]() 也即键长:
也即键长:![]()
这个位置还可以用更加简洁的思维进行处理,在“金刚石晶胞的1/8”这个最小的单元中,碳原子A、B、C、D应该是与碳原子E紧密相切,E出于“金刚石晶胞的1/8”的提心位置,所以AE长度是“金刚石晶胞的1/8”这个小正方体体对角线的一半,也即AE=![]() ,AE= l=2r,化简得到l=2r =
,AE= l=2r,化简得到l=2r =![]() ,解出
,解出![]() 也即键长:
也即键长:![]()
1mol 金刚石质量12g,,含NA个C原子,一个金刚石晶胞体积是![]() ,而每个晶胞内含8个C原子,所以密度有:
,而每个晶胞内含8个C原子,所以密度有:
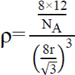 (用碳原子半径表示)
(用碳原子半径表示)
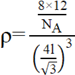 (用C—C键长表示)
(用C—C键长表示)
空间利用率有:
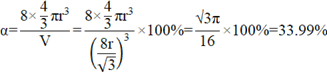
方法二:几何法优化
在方法一的基础上,将方法一进行优化,省去复杂的计算。将晶体结构中每个原子看成刚性小球,则从金刚石中取出的金刚石晶胞的1/8是个小立方体,立方体中的ABCDE五个原子中ABCD都应与E紧密相切,如此,AE则为该立方体体对角线的一半,相关计算如下:
设晶胞边长为A,C—C键长为l,碳原子半径为r
则有:l=2r
体对角线Ag=![]() ,则AE=
,则AE=![]()
又AE=l=2r,则2r=![]() ,得出r=
,得出r=![]()
晶体密度和空间利用率的后续计算同方法一。
方法三:向量法
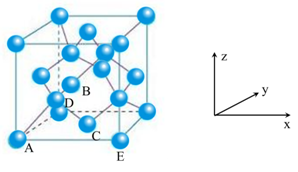
图1‑3
设晶胞边长为a,C—C键长为l,碳原子半径为r
则有:l=2r AE=a
如图1-3所示,建立空间直角坐标系,A为坐标系原点。
则:A(0,0,0) E(![]() )c(
)c(![]() ) B(
) B(![]() ) D(
) D(![]() )
)
故![]() ,
,![]()
![]() =A,
=A,![]() =
=![]()
也即l=![]() ,则r=
,则r=![]()
晶体密度和空间利用率的后续计算同方法一。
在金刚石晶体结构的基础上,将碳原子(C)换成硅原子(Si)或锗原子(Ge),即可得到硅晶体或锗晶体,这两种晶体的所有分析均与金刚石晶体相似或相同。
2、二氧化硅晶体
在硅晶体的基础上,在硅硅原子(Si—Si)之间插入O原子,就得到SiO2晶体(如图2-1),也是一种典型的原子晶体。
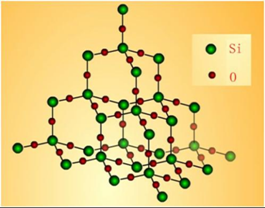
图2‑1
与金刚石晶体不同的是,SiO2晶体中最小的环不再是六元环,而为十二元环。其中每一个Si原子被4个O原子包围在正四面体的体心位置,与4个O原子形成4个Si—O键,这4个Si—O键是处于小正四面体体心位置的Si原子与4个O原子独立形成,不与其他Si原子共用,因此,1mol SiO2中含4mol Si—O。
一个Si原子被4个O原子所共用,而一个O原子被2个Si原子所共用,故SiO2晶体 n(Si) :n(O)=1:2。因此SiO2化学式中的下标也只表示晶体中硅原子与氧原子的个数比。
3、石墨晶体
石墨晶体是一种混合型晶体。这是由于它的结构所决定的。石墨晶体结构如图3-1所示所示
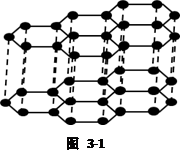

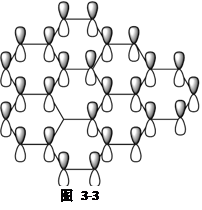
石墨晶体是层状结构,碳原子为sp2杂化,层内每6个碳原子通过共价键形成一个六元环,每个碳原子被3个六元环所共用,如图3-2。层与层之间则通过范德华力结合一起。由于石墨晶体中,碳原子为sp2杂化,故每一个碳原子还有一个未参与杂化的含1个电子的P轨道,这些P轨道垂直于六元环所在的平面而互相平行,同时相邻两碳原子之间的距离较短(142pm),这些P轨道则可以肩并肩形成离域大π键(也称金属键),从而使得石墨具有导电性,离域大π键是在层内形成,所以石墨的横向(层内横向)导电能力就比纵向(层与层纵向)导电能力强,这也体现了晶体的各向异性的特点。
鉴于石墨晶体中除了有共价键外,还有金属键以及范德华力,有着原子晶体和金属晶体的某些共性,石墨晶体就不能简单归为原子晶体或金属晶体,也就将其划分为混合型晶体。同时由于石墨晶体中的碳碳键长(142pm)比金刚石晶体中的碳碳键长(154pm)小,又有金属键和范德华力,使得石墨的熔点高于金刚石。
石墨晶体中,每个碳原子被3个六元环所共有,故每个六元环独立占有的碳原子为![]() 个;每个碳原子与周围的3个碳原子形成3个碳碳键,每一个碳碳键中,两端的碳原子各自贡献
个;每个碳原子与周围的3个碳原子形成3个碳碳键,每一个碳碳键中,两端的碳原子各自贡献![]() ,则碳原子(C)与碳碳键(C—C)个数比为
,则碳原子(C)与碳碳键(C—C)个数比为![]() ,也即石墨晶体 n(C) :n(C—C)=2:3,1mol 石墨晶体中则含有1.5mol C—C。
,也即石墨晶体 n(C) :n(C—C)=2:3,1mol 石墨晶体中则含有1.5mol C—C。
4、试题赏析
1.【2016全国卷I节选】(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为,微粒之间存在的作用力是 。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数a为(0,0,0);b为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为_________________。
,0)。则D原子的坐标参数为_________________。
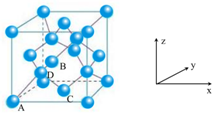
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为__________g·cm-3(列出计算式即可)。
2.【2015全国卷I节选】(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
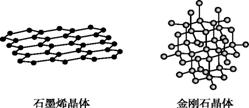
①在石墨烯晶体中,每个C原子连接 个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。
3.【2016全国卷III节选】(5)GaAs的熔点为1238℃,密度为ρ g·cm−3,其晶胞结构如图所示。该晶体的类型为___________,Ga与As以________键键合。Ga和As的摩尔质量分别为M(Ga) g•mol−1和M(As) g•mol−1,原子半径分别为r(Ga)pm和r(As)pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

4.【2016海南节选】(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为______g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
试题分析:2015年高考全国卷I直接考查金刚石晶体和石墨晶体,2016年全国卷I和卷III只是将元素进行了替换,晶体结构依旧还是金刚石晶体结构特点。从上述所选的4道高考题可以看出,原子晶体的考查基本以金刚石晶体为雏形,只是相应的将碳原子换成其他原子而已,学生掌握金刚石晶体结构和石墨晶体结构对认识理解这一类型的晶体结构有非常大的帮助。因此教学中,帮助学生建立模型是非常有必要的。
总结:认识晶体的结构,要充分建立微粒观,从微观角度去认识晶体的形成以及其结构特点,再从其晶体的微观结构去认识晶体的宏观性质,对掌握晶体的相关知识也就容易许多。学生从微观认识金刚石晶体的结构,知道金刚石是碳原子通过共价键形成的晶体,就不难理解金刚石硬度大,熔点高的特点,知道石墨晶体中的碳原子是sp2杂化,有一个未杂化的p轨道形成金属键,它就不难理解石墨的导电原理,知道金刚石晶胞结构微观特点,对其密度和空间利用率的计算理解上也就比较容易。
晶体的学习,要求学生在化学的基础上巧用数学技巧来学习,因此要多开发学生的数学思维、空间想象能力,培养学生的微观思维。

- 全部评论(0)
