复习讲义:全面认识铝及其化合物
时间:2019-08-06 21:31 来源:未知 作者:淮畔化学 点击: 次 所属专题: 铝及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
就高考备考中,尤其关于铝的知识给同学们列出以下复习提纲:
1、概括为两大部分:铝的游离态——即铝单质、铝的化合态——即铝的化合物(包括含铝元素的碱、铝盐、偏铝酸盐、氧化物)
2、铝单质的六个方面:
(1)铝原子结构、基态铝原子(铝离子)价电子排布、晶体铝结构(六方最密)
(2)铝在周期表中的位置、原子半径、离子半径、电离能的变化
(3)金属铝物理性质(色、态、密度、熔沸点、硬度、导热、导电)
(4)金属铝化学性质(金属性很强、失电子能力很强、还原性很强)
(5)金属铝的用途
(6)金属铝的制备
3、含铝元素的氧化物——氧化铝
4、含铝元素的碱——氢氧化铝
5、含铝元素的盐——铝盐(Al3+)、偏铝酸盐(AlO2-)
6、氯化铝
7、工业制铝
早在公元前5世纪,人们就应用明矾作收敛剂、媒染剂,所以铝是我们非常熟悉的金属。1825年,丹麦化学家和矿物学家Oersted用钾汞齐还原无水氯化铝,首次制备出不纯的金属铝。1827年,德国化学家Wohler用金属钾还原无水氯化铝,制备出较纯的铝。铝的英文名称为Aluminium,源自拉丁语“Alumen”意为“收敛性矾”。
铝是地球表面上存在的最丰富的金属元素,并且分布广泛,在地壳中铝含量高达8.8%(质量),仅次于氧、硅,在全部金属元素中铝占第一位。但是自然界未发现过游离态的铝。海水中平均含0.16~0.19g/ton的铝。铝广泛存在于植物中,特别是在潮湿和酸性的土壤中生长的植物有相当高的含铝量。
铝(Aluminum)是最重要的有色金属之一,全世界每年生产在1.5×107吨以上。铝土矿储量约2.3×1010吨。
由于铝的密度小,它的合金被广泛应用于建筑、交通、电力、化学、食品包装、机器制造和日用品等工业,其中建筑业的用铝量最大。
铝是一种战略金属,在军事工业上用铝合金制造飞机、舰艇、装甲车和坦克的部件,高纯铝具有更好的导电性、可塑性、反光性和抗腐蚀性,用做各种无线电器件、天文望远镜的反射镜、装浓硝酸和双氧水的容器。
最重要的铝的化合物有氧化物、氢氧化物、氯化物、硫酸盐、明矾等。其中氢氧化铝是制备大多数铝化合物的原料,某些铝的化合物在医药上得到了应用,如铝的氢氧化物、磷酸盐、碱式碳酸盐等已广泛用于治疗胃溃疡、十二指肠溃疡和胃酸过多症。铝的卤化物是重要的Friedel-Crafts反应的催化剂。
今天我们就来认识一下铝及其化合物。
第一部分:金属铝
一、铝原子结构、基态铝原子(铝离子)价电子排布、晶体铝结构(面心立方)
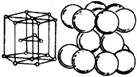
1、铝原子(及铝离子)结构
由此我们可以看出,铝的最外层电子数为3,易失去最外层上的3个电子,
故常见化合价为+3价。
2、铝原子(及铝离子)的(价)电子排布
基态Al:1s22s22p63s23p1,简写为[Ne]3s23p1
价电子排布为3s23p1。
价电子轨道表达式如图

3、金属铝晶体结构:面心立方最密堆积
二、铝在周期表中的位置、同位素、存在、成键特点
1、铝在周期表中的位置
第三周期ⅢA族,属p区元素,与B、Ga、In、Tl称为硼族元素。
2、同位素
铝的同位素有23Al、24Al、25Al、26Al、27Al、28Al、29Al、30Al。
3、存在
铝在自然界中主要以硅铝酸盐的形式存在于各种矿物岩石中,如长石、云母、高岭土等。铝土矿和冰晶石也是含铝的重要矿物,是提炼铝的重要原料。
4、成键特点
(1)Al在化合物中经常表现为+3氧化态(即化合价),由于Al3+有强极化能力,在化合物中常显共价型,表现为缺电子特征,所以分子可以自身聚合成生成的化合物。
(2)Al原子有空的3D轨道,可以形成配位数为6的稳定化合物。

说明:铝所在的ⅢA族的价电子排布为ns2np1,价电子总数为3。在与其他原子成键时,价电子层处于未充满状态(ns2npx2npy2npz0),比稀有气体构型缺少一对电子。所以+3价的Al形成的化合物叫做缺电子化合物。这样的化合物还有很强的继续接受电子的能力,这种能力表现在分子的自身聚合以及同电子给予体形成稳定的配位化合物等方面。
三、金属铝物理性质(色、态、密度、熔沸点、硬度、导热、导电)
银白色具有金属光泽的固体,熔、沸点较高(分别为930K、2740K),质软,密度较小(2.7g/cm3),有良好的导热、导电和延展性。
四、金属铝化学性质
铝是一个相当活泼的金属,电极电位为-1.662V。具有亲氧性,一旦铝接触空气,表面立即氧化生成一层致密的氧化膜,此膜可阻止铝进一步被氧化,且此膜不溶于水和酸,因此铝在空气中相当稳定。只有此膜被破坏时,铝的活泼性才能表现出来。如铝片表面有铝汞齐生成时,将其放置于空气中,其表面便有大量蓬松的氧化铝生成,将此铝片放入水中,还可观察到有氢气放出。
铝的亲氧性还表现为铝能夺取化合物中的氧。
下面我们一一给同学们梳理。
主要的化学性质如下:
1、与非金属单质(如O2、Cl2)的反应
(1)与O2常温下形成致密的氧化膜
(2)与O2点燃时:4Al+3O2![]() 2Al2O3
2Al2O3
(3)与Cl2点燃时:2Al+3Cl2![]() 2AlCl3
2AlCl3
2、与酸反应
(1)与非氧化性的酸(稀盐酸):2Al+6H+===2Al3++3H2↑
(2)与氧化性酸(稀硝酸):Al+NO3-+4H+=== Al3++NO↑+2H2O
(3)常温下,遇冷的浓硫酸、浓硝酸钝化
①常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。利用这一性质常用铝桶装运浓H2SO4、浓HNO3等化学试剂。
②铝可以溶于热的浓硫酸中:2Al+6H2SO4(浓、热)===Al2(SO4)3+3SO2↑+6H2O。
③能与铝反应产生氢气的溶液可能呈强酸性也可能呈强碱性。
3、与强碱反应
2Al+2OH-+2H2O=== 2AlO2-+3H2↑
说明:
①在中学阶段,一般不认为单质铝具有两性,但是在高校无机化学学习中,铝是两性金属。
②高纯度的铝(99.95%)不与一般的酸作用,只溶于王水。
③经光谱实验证实,Al(OH)3溶于碱生成的化合物是Na[Al(OH)4],而非NaAlO2,但因历史原因中学阶段可以写成NaAlO2。
4、与金属氧化物反应(铝热反应)
铝粉与某些金属氧化物(Fe2O3、V2O5、Cr2O3、MnO2等)在较高温度下发生剧烈反应并放出大量的热,这些化学反应叫做铝热反应。

Fe2O3+2Al![]() Al2O3+2Fe
Al2O3+2Fe
在铝与氧化铁的反应中,镁条、氯酸钾起引燃剂的作用,用引燃剂点燃后,反应即猛烈进行,放出的热使体系温度高达3273K以上,可使Fe熔化。
五、工业炼铝
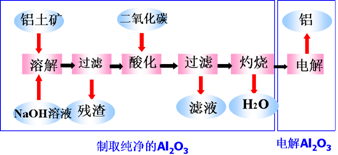
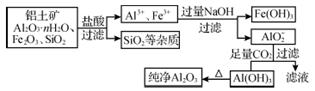
从铝土矿出发制取金属铝,一般要经过Al2O3的纯制和Al2O3的熔融电解两步。
(1)提取纯净的Al2O3
先用碱溶液处理铝土矿(Al2O3·2H2O)或用苏打焙烧铝土矿,使难熔的Al2O3变为可溶性的铝酸盐。
Al2O3(s)+2NaOH===2NaAlO2+H2O
Al2O3(s)+Na2CO3(s)===2NaAlO2(s)+CO2↑
产物变为溶液后,澄清过滤除去不溶性杂质,通入CO2,促使铝酸盐水解得Al(OH)3沉淀。
2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3
将Al(OH)3过滤分离,干燥后煅烧,可得较纯的符合电解要求的氧化铝。
2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
将Al2O3溶解于熔融的冰晶石(Na3AlF6)中进行电解,在阴极可得铝。电解铝的纯度可达98%~99%。
(2)电解
用冰晶石(Na3AlF6)作助熔剂,以降低Al2O3的熔点,化学方程式为
![]()
六、金属铝的用途
1、纯铝用作导线;
2、铝合金广泛应用于电讯器材、建筑设备以及汽车、飞机、宇航飞行器及生活用品的制造;
3、炼钢厂利用铝的亲氧性作脱氧剂。
第二部分:铝的化合物
一、氧化铝
白色固体,难溶于水,晶体硬度大,Al2O3熔点很高(2642℃),可作耐火材料,是一种两性氧化物。
1、与强酸反应:Al2O3+6H+===2Al3++3H2O
2、与强碱反应:Al2O3+2OH-===2AlO2-+H2O
所以Al2O3坩埚不能用于熔融NaOH固体
【拓展延伸】:
Al2O3是一种白色难溶于水的粉末。它有多种变体,其中最重要的是α—型Al2O3和γ—型Al2O3。
上述可溶于酸和碱的是γ—型Al2O3。
α—型Al2O3俗称刚玉,硬度大,不溶于水、酸、碱。
有些氧化铝晶体透明,因含有杂质而呈现鲜明颜色。

二、氢氧化铝Al(OH)3
氢氧化铝是白色胶状固体,具有较强的吸附性,难溶于水,是典型两性氢氧化物,不能与较弱的酸、碱反应。
1、电离
H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-
Al3++3OH-
氢氧化铝可以看作一元弱酸或三元弱碱,能与强酸、强碱反应,不能和弱酸、弱碱反应。
2、与强酸(H+)反应
2Al(OH)3+6H+===2Al3++3H2O
3、与强碱(OH-)反应
Al(OH)3+OH-===AlO2-+2H2O
Al(OH)3具有两性,能溶于强酸(如盐酸)、强碱(如NaOH溶液),但不溶于弱酸(如H2CO3)、弱碱溶液(如氨水)。
4、与铵盐(NH4+)不反应
Mg(OH)2与浓NH4Cl溶液是可以反应的,但Al(OH)3与浓NH4Cl溶液不反应,故Al(OH)3不溶于NH4Cl浓溶液
5、不稳定性
Al(OH)3与Mg(OH)2在受热时的表现相似,不稳定,分解为相应的氧化物。
2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
热分解生成的气态水和Al2O3有助于灭火,Al(OH)3可作无机阻燃剂。
6、氢氧化铝的用途
(1)治疗胃酸过多
(2)Al(OH)3胶体可用于净水
三、含铝元素的盐——铝盐(Al3+)
1、与强碱(OH-)反应:Al3++4OH-(足量)===AlO2-+2H2O
2、与弱碱(NH3·H2O)反应:Al3++3NH3·H2O(足量)===Al(OH)3↓+3NH4+
3、与弱酸的酸根离子(CO32-、HCO3-、AlO2-、S2-、HS-等)发生互促水解
Al3++3HCO3-=Al(OH)3↓+3CO2↑。
铝盐的水解在实际生活中具有重要意义。例如油井固砂、铸造中砂制成型,印染中色素在织物上的附着,都离不开水解产物Al(OH)3的作用。明矾也是利用水解性质来达到净化水的目的。
四、含铝元素的盐——偏铝酸盐(AlO2-)
氢氧化铝是白色固体、难溶于水,熔点高,是典型两性氢氧化物,不能与较弱的酸、碱反应。
1、与强酸反应:
AlO2-+H+(少量)+H2O=== Al(OH)3↓
AlO2-+4H+(足量)=== Al3++2H2O
2、与弱酸反应:
2AlO2-+CO2(少量)+3H2O===2Al(OH)3↓+CO32-
AlO2-+CO2(足量)+2H2O=== Al(OH)3↓+HCO3-
3、与弱碱阳离子(NH4+、Al3+、Fe3+等)发生互促水解:
4、与弱酸的酸式盐(HCO3-)反应:
AlO2-+HCO3-+H2O===Al(OH)3↓+CO32-
五、氯化铝
1、氯化铝的结构
铝的卤化物中AlF3是离子晶体,AlCl3、AlBr3、AlI3是分子晶体。
AlCl3中的Al是缺电子原子,有空轨道,Cl原子有孤对电子,因此可以通过配位键形成具有桥式结构的双聚分子Al2Cl6。
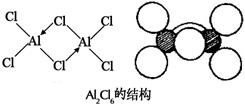
下面我们来说一说AlCl3的二聚体Al2Cl6的中的氯桥键(三中心四电子键)。
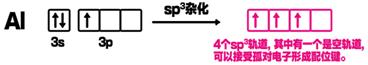
首先研究一下Al的价电子为3s23p1,中心Al原子采取sp3杂化(不等性杂化),2个四面体共用2个Cl原子(共棱),形成桥式结构,桥式氯原子在与左面的铝成σ键的同时,与右面的铝的空轨道发生配位。也可以认为氯桥键是一个三中心四电子键,左面的铝提供一个电子,桥式氯提供三个电子。也就是说,两个Al分别在由Cl密堆积所形成的相邻的两个四面体空隙中。
如图:
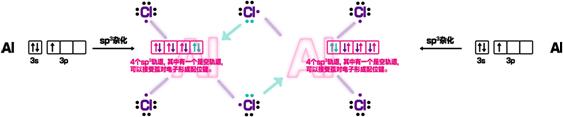
(左Al:1eˉ、中上Cl:2eˉ、右Al:1eˉ)
上下共两个三中心四电子氯桥键,其中绿色为配位键。
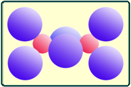
从上述分析中可知,Al2Cl6中含有配位键,2个Al原子与两侧的4个Cl原子在同一平面上,中间的2个Cl原子位于该平面两侧。形成了两个三中心四电子键,形状为2个共棱的四面体。
2、氯化铝的性质
氯化铝是含有共价键的分子晶体,白色晶体,在空气中易潮解,熔点低,177.8℃升华,易溶于乙醇、乙醚、苯等有机溶剂,易形成双聚物,

无水AlCl3易挥发,几乎可以溶解在所有的有机溶剂中,易溶于水并强烈水解(如图)产生白烟,溶解在盐酸中可得到AlCl3·6H2O。无水AlCl3主要用来做Friedel-Crafts反应的酸性催化剂。
AlCl3+3H2O===Al(OH)3+3HCl
第三部分 :与铝相关的框图题中常见的突破口
1、与强酸、强碱都反应的金属一般是铝
2、与强酸、强碱都反应的氧化物一般是Al2O3
3、与强酸、强碱都反应的氢氧化物一般是Al(OH)3
4、工业产量居第二位的金属是铝
5、地壳中含量最高的金属元素是铝元素
第四部分:常见的与强酸、强碱溶液都反应的物质
1、单质:Al
2、两性氧化物:Al2O3
3、两性氢氧化物:Al(OH)3。
4、弱酸弱碱盐:(NH4)2CO3、CH3COONH4等
(NH4)2CO3+2HCl===2NH4Cl+CO2↑+H2O
(NH4)2CO3+2NaOH===Na2CO3+2NH3↑+2H2O
5、弱酸的酸式盐:NaHCO3等。
NaHCO3+HCl===NaCl+CO2↑+H2O
NaHCO3+NaOH===Na2CO3+H2O
6、氨基酸
第五部分:生活中含“铝”的物质
1、斯达舒
2、海蜇、油条、麻花、粉条、膨化食品、面点类

- 全部评论(0)
(2831990485) 评论 href="/plus/view.php?aid=17518">复习讲义:全面认识:Al(OH)3与盐酸的反应配错了

