碳酸氢盐的性质
时间:2019-08-04 15:54 来源:未知 作者:赵斌 点击: 次 所属专题: 碳酸氢盐 碳酸氢钠01
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

式中的K只是表观电离常数,是假定所有溶于水的CO2全部转化为H2CO3计算出来的。实际碳酸的K1,K2都要比上面的对应数值要大。
在碳酸的水溶液中,受第一步电离的抑制,HCO3-的电离平衡常数较小。
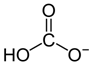


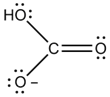
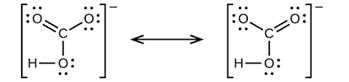
它的性质可以归纳为:
1.溶解性
所有碳酸氢盐都溶于水,ⅠA族的碳酸盐溶解度大于碳酸氢盐,原因是HCO3-在水溶液中通过氢键形成双聚或多聚离子。
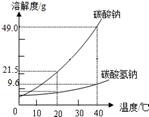
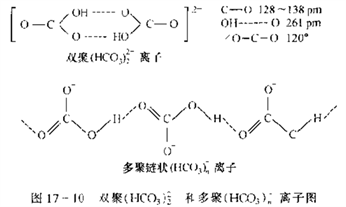
这也是侯氏制碱法的原理。
2.热稳定性
碳酸氢盐热稳定性差,受热易分解。

![]()
碳酸氢盐的热稳定性一般比相应的碳酸盐差。
3.电离(弱酸性)
![]() Ka2= 5.61×10-11
Ka2= 5.61×10-11
HCO3-有微弱的电离,可以看做一元弱酸。
![]() (本质上就是一个酸碱反应。)
(本质上就是一个酸碱反应。)
【练习】
写出碳酸氢钠与氢氧化钡按照物质的量比为1:1,1:2反应时的离子方程式。
4.水解(弱碱性)
![]() (Kh= 2.3×10-8)
(Kh= 2.3×10-8)
![]()
【练习】
(07年全国卷)0·1mol/L NaHCO3的溶液的pH最接近于()
A.5.6 B.7.0 C.8.4 D.13.0
碳酸氢钠由于HCO3-会水解,水解后溶液呈碱性,所以先排除A与B两个选项.
A是酸性的,B是中性的.
假设溶液是0.1mol/L 的NaOH溶液,那么其pH是等于13.0,因为NaOH是强碱.
但现在溶液的碱性并不是强碱电离产生的,而是由NaHCO3水解产生的,所以碱性不可能达到pH=13.
因此本题应该选C
![]()
这个反应可以从两方面理解:
①强酸制弱酸,H2CO3的电离平衡常数小于强酸(无K制有K)
②外来H+促进了HCO3-的水解。
【思考】
下面这个图,大家不陌生。可以从强制弱和水解两个角度进行分析。
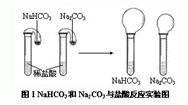
碳酸钠与碳酸氢钠的常用鉴别方法:
①加稀盐酸
将这两种物质配制成溶液,并分别装入两个烧杯,向溶液中同时滴加稀盐酸,迅速有气泡产生的是碳酸氢钠溶液,而过一段时间缓慢产生气泡的是碳酸钠溶液。离子方程式:
HCO3-+H+=H2O+CO2↑,CO32-+2H+=H2O+CO2↑。
从离子方程式中可以看出碳酸钠和碳酸氢钠与盐酸反应实质是HCO3-和CO32-分别与H+结合生成碳酸,碳酸不稳定分解为H2O和CO2,而每一摩尔HCO3-只需要结合一摩尔H+,每一摩尔CO32-却要结合两摩尔H+,故NaHCO3的反应速率快些。
②通入二氧化碳
分别取10mL 两种饱和溶液于试管中,分别向两溶液中通入CO2,溶液变浑浊的是碳酸钠,无明显变化的是碳酸氢钠。向饱和碳酸钠溶液中通入CO2,CO2与碳酸钠发生反应:Na2CO3+H2O+CO2=2NaHCO3↓溶液中水的质量减少,生成的碳酸氢钠的质量比原溶液中碳酸钠的质量多,且碳酸氢钠在水中的在水中的溶解度不碳酸钠小,故有晶体析出,溶液变浑浊。而碳酸氢钠不与CO2反应,向碳酸氢钠溶液中通入CO2无明显现象。
碳酸氢钠水溶液中HCO3-既可以电离又可以水解,是一个矛盾集合体:
![]()
它的水溶液的酸碱性就由两个K的相对大小决定。
碳酸氢钠与酸或碱的反应可以用平衡移动原理解释:
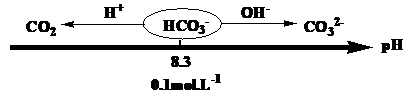
5.发生双水解沉淀
![]()
泡沫灭火器和炸油条的原理。
【制作油条的过程若添加含铝的膨松剂,若经常食用,长久下来则有摄入多量铝的风险,尤其是发育中的儿童。人体的铝含量过高,对脑部组织和智力有损害,引起记忆力减退与智力退化。且铝摄取过多会降低饮食中磷的吸收,造成骨骼含钙量减少,严重时可能容易发生骨折。因此建议业者使用不含铝的配方制作,以保障消费者的健康。】
6.提供H+沉淀
AlO2- + HCO3-+ H2O = Al(OH)3↓+ CO32-
质子传递反应,可以用强酸制弱酸原理解释。
7.提供CO32-而沉淀
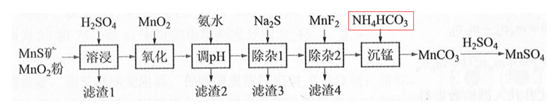
例如今年的Ⅲ卷:
26.(14分)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉
与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
![]()
限于篇幅,我们看看今年的高考题关于碳酸氢盐的考查:
2019年Ⅰ卷
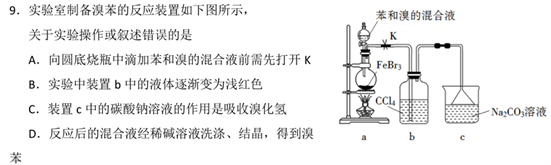
关键词:溶解度
碳酸钠的溶解度比碳酸氢钠大,可以多吸收一些HBr,吸收效果好。
2019年Ⅰ卷
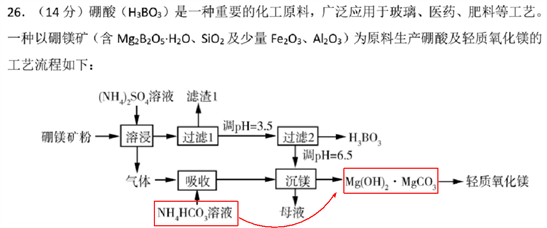
【关键点】NH4HCO3与NH3反应,生成(NH4)2CO3(可以看作氨水与碳酸铵的混合溶液),HCO3-提供CO32-沉淀。
2019年Ⅲ卷
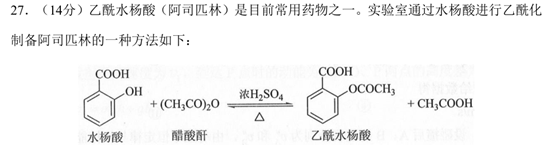


【关键点】强酸制弱酸,羧基的酸性比碳酸强。HCO3-起到分离杂质,提纯产品的作用。
参考资料:《无机化学》北师大第四版

- 全部评论(0)
