晨读笔记:镁、铝、铜、合金
时间:2023-08-09 16:32 来源:未知 作者:化学自习室 点击: 次 所属专题: 铝及其化合物 铜及其化合物 合金
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、镁及其化合物
01. Mg能与空气中的O2反应,生成一层坚固而致密的氧化物保护膜.所以,金属镁有抗腐蚀性。
02.Mg在空气中的燃烧主要反应:2Mg+O2 2MgO,
2MgO,
次要反应:与N2反应生成少量的Mg3N2(离子化合物),3Mg+N2 Mg3N2,
Mg3N2,
与少量CO2反应,2Mg
+ CO2 2MgO + C
2MgO + C
03.与Cl2的反应:Mg+Cl2 MgCl2
MgCl2
04.与S的反应:Mg + S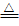 MgS
MgS
05.与水的反应(热水):Mg+2H2O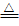 H2↑+Mg(OH)2
H2↑+Mg(OH)2
06.与稀H2SO4、稀HCl等弱氧化性酸(产生H2):Mg+2H+===Mg2++H2↑。
07.与浓HNO3反应出NO2:Mg+4HNO3===Mg(NO3)2+2H2O+2NO2↑
08.与稀HNO3反应:3Mg+8HNO3===3Mg(NO3)2+2NO↑+4H2O,
硝酸浓度不同产物不同,浓度越小N的化合价越低。
如Zn与极稀的HNO3反应:4Zn+10HNO3===4Zn(NO3)2+NH4NO3+3H2O
09.与浓H2SO4反应Mg+2H2SO4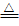 SO2↑+2H2O+MgSO4,浓H2SO4氧化性不如HNO3,需要加热。
SO2↑+2H2O+MgSO4,浓H2SO4氧化性不如HNO3,需要加热。
10.与CuSO4溶液:Mg+CuSO4+2H2O===Cu(OH)2↓+MgSO4+H2↑,与钠和盐溶液反应的原理类似。
11.镁的特征反应,与浓NH4Cl反应 Mg + 2NH4Cl = MgCl2 + 2NH3↑ + H2↑
原理:NH4+易水解,溶液显酸性,加入镁后放出H2,生成的一水合氨水分解产生NH3。
12.镁的工业冶炼法——熔融电解法,用MgCl2为原料进行电解,MgCl2的熔点低,易熔融,耗能少,不用MgO的原因是而MgO的熔点高,耗能大。
二、铝及其化合物
01.铝是地壳中最多的金属元素,主要是以化合态存在,铝土矿主要成分是Al2O3。
02.常温下与空气中的氧气反应生成坚固的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触(加热发红,但不滴落),4Al+3O2===2Al2O3,在氧气中点燃剧烈燃烧。4Al+3O2 2Al2O3
2Al2O3
03.与硫高温反应, 2Al + 3S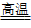 Al2S3,只能在干态下制备,原因是Al2S3遇水立即发生反应。
Al2S3,只能在干态下制备,原因是Al2S3遇水立即发生反应。
Al2S3+6H2O= 2Al(OH)3↓+3H2S↑
04.与非氧化性酸反应 2Al+6HCl===2AlCl3+3H2↑;2Al+3H2SO4===Al2(SO4)3+3H2↑
05.铝在冷的浓硫酸、浓硝酸中钝化。
06.钝化:某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应。常见的会发生钝化的金属主要有铝、铁。
07.与强碱反应:2Al+2NaOH+2H2O===2NaAlO2+3H2↑化合价降低,得6e-,被还原,
反应的实质:分两步进行2Al+6H2O===2A1(OH)3+3H2↑,Al(OH)3+NaOH===NaAlO2+H2O
08.铝热反应:2Al+Fe2O3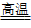 2Fe+ Al2O3 ,其中Al+Fe2O3为铝热剂,是混合物。
2Fe+ Al2O3 ,其中Al+Fe2O3为铝热剂,是混合物。
09.铝热反应放出大量的热,因此其应用有①焊接冶炼难熔的金属;②冶炼难熔金属(Fe,Mn,Rb)
10.刚玉的主要成分是Al2O3,其中把含少量铬元素的刚玉称为红宝石;
含少量的铁和钛元素的刚玉称为蓝宝石。
11.电解熔融的氧化铝制备单质铝:2Al2O3 4Al+3O2↑,由于氧化铝的熔点很高,故在氧化铝中添加冰晶石Na3AlF6,助其熔融,不电解AlCl3的原因是其为分子晶体,熔化时不导电。
4Al+3O2↑,由于氧化铝的熔点很高,故在氧化铝中添加冰晶石Na3AlF6,助其熔融,不电解AlCl3的原因是其为分子晶体,熔化时不导电。
12. Al2O3是两性氧化物(既能与酸反应又能与碱反应生成盐和水的氧化物),
与酸反应:Al2O3+6HCl===2AlCl3+3H2↑;Al2O3+3H2SO4===Al2(SO4)3+3H2O,
与碱反应: Al2O3+2NaOH===2NaAlO2+H2O。
13.氢氧化铝是白色胶状物质,不溶于水,有强的吸附性,可用于吸附水中的悬浮物和各种色素。
14.Al(OH)3是两性氢氧化物,
①与酸反应:Al(OH)3+3HCl===AlCl3+3H2O
②与碱反应:Al(OH)3+NaOH===NaAlO2+2H2O
15.受热分解2Al(OH)3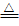 Al2O3+3H2O,难溶于水的氢氧化物易分解为相同价态的氧化物和水。
Al2O3+3H2O,难溶于水的氢氧化物易分解为相同价态的氧化物和水。
16.将NaOH滴加入AlCl3溶液中至过量现象:先有白色沉淀后沉淀消失。
Al3++3OH-===Al(OH)3 ↓ ; Al3++4OH-===AlO2-+2H2O
17.AlCl3滴加入NaOH溶液中至过量现象:先无任何现象后有白色沉淀生成。
Al3++4OH-===AlO2-+2H2O ; Al3++ 3AlO2-+6H2O===4Al(OH)3↓
18.实验室常用可溶性铝盐 + 弱碱反应制备氢氧化铝,弱碱选择足量氨水
Al2(SO4)3+6NH3•H2O===2Al(OH)3↓+3(NH4)2SO4
19.明矾:十二水合硫酸铝钾[KAl(SO4)2•12H2O]易溶于水,其净水原理:明矾溶于水发生水解反应,生成Al(OH)3胶体,吸附水中的杂质,使水澄清。
三、铜及其化合物
01.铜紫红色、不能被磁体吸引。
02.铜与O2反应,加热时:2Cu+O2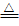 2CuO;
2CuO;
常温下在潮湿的空气中:2Cu+O2+H2O+CO2====Cu2(OH)2CO2。
03.与Cl2反应:Cu+Cl2 CuCl2(棕黄色烟)。
CuCl2(棕黄色烟)。
04.铜与非氧化性酸不反应,与浓硫酸、稀浓硝酸都反应。
05.铜与浓硫酸的反应:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
06.铜与浓硝酸的反应:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O;
铜与稀硝酸的反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
07.铜与硝酸银溶液的反应:Cu+2Ag+==Cu2++2Ag,与氯化铁溶液的反应:2Fe3++Cu==2Fe2++Cu2+。
08.氧化铜是黑色固体和氧化亚铜是砖红色固体。
09.氧化铜是碱性氧化物,能与酸反应CuO+2H+===Cu2++H2O。
10.氧化亚铜与酸反应发生歧化反应Cu2O+2H+===Cu2++Cu+H2O。
11.氧化铜加热能分解生成氧化亚铜。4CuO 2Cu2O+O2↑。
2Cu2O+O2↑。
12.氢氧化铜是蓝色不溶于水的固体,属于弱碱,能与酸反应生成盐和水。
13.CuSO4·5H2O为蓝色晶体,俗称蓝矾、胆矾。
无水CuSO4为白色粉末,遇水变蓝色(生成CuSO4·5H2O),可作为水的检验依据。
四、合金
01.合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
02.合金的性能:硬度比 组分金属硬度大,熔点比组分金属的熔点低。
03.合金具有各成分金属的化学性质,合金一定是混合物。
04.合金形成后会影响各成分金属的物理性质,如合金的熔点一般比成分金属低,而硬度、机械强度一般比成分金属高;但一般来说各成分金属均保持了其原有的化学性质。
05.钢是用量最大、用途最广的合金,根据其化学成分,可分为两大类:碳素钢和合金钢。
06.生铁和钢是含碳量不同的铁碳合金。
07.生铁的含碳量2%~4.3%,钢的含碳量0.03%~2%。
08.低碳钢的含碳低于0.3%,韧性好、焊接性好,强度低
09.中碳钢的含碳低于0.3%~0.6%,强度高,韧性及加工性好,
10.高碳钢的含碳低于0.6~2.0%,硬而脆,热处理后弹性好
11.合金钢也叫特种钢,是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种特殊性能,如强度、硬度大,可塑性、韧性好,耐磨,耐腐蚀等。
12.不锈钢是最常见的一种合金钢,它的合金元素主要是铬(Cr)和镍(Ni)。
13.向铝中加入少量的合金元素,如Cu、Mg、Si、Mn、Zn及稀土元素等,可制成铝合金。
14.储氢合金:是一类能够大量吸收H2,并与H2结合成金属氢化物的材料。
15.具有使用价值的储氢合金,要求储氢量大,金属氢化物既容易形成,稍稍加热又容易分解,
室温下吸、放氢的速率快。如Ti-Fe合金和La-Ni合金等,可以用于以H2为燃料的汽车。
16.钛合金:钛合金强度高、耐蚀性好、耐热性高。主要用于制作飞机发动机压气机部件,以及火箭、导弹和高速飞机的结构件,还可以用于制造耐压球。
17.K-Na合金在常温下是液态,用作核反应堆的导热剂。
五、金属材料与矿物冶炼
01.金属的分类:
(1)根据冶金工业标准分类:铁(铬、锰)为黑色金属,其余金属(钠镁铝等)为有色金属。
(2)根据密度分类:密度大于4.5g/cm3的金属是重金属:如铁、铜、铅、钡;
密度小于4.5g/cm3的金属是轻金属:如钠、镁、铝。
02.从矿石中提取金属的一般步骤有三步:
①富集:除去杂质,提高矿石中有用成分的含量;
②冶炼:利用氧化还原反应,在一定条件下,用还原剂将矿石中的金属离子还原成金属单质;
③精炼:采用一定的方法,提炼纯金属。
03.冶炼金属的实质:用还原的方法,使金属化合物中的金属离子得到电子变成金属原子。
04.金属冶炼的一般方法有:①电解法;②热还原法;③热分解法。
05.电解法:适用于冶炼活动性强的金属。如K、Ca、Na、Mg、Al等活泼的金属,通过电解其熔融盐氯化物或氧化物的方法来制得。例如:2Al2O3 4Al
+ 3O2↑ ; 2NaCl
4Al
+ 3O2↑ ; 2NaCl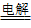 2Na + Cl2↑
2Na + Cl2↑
06.热还原法:适用于冶炼金属活动顺序表中Zn、Fe、Sn、Pb等中等活泼的金属。
常用的还原剂有C、CO、H2、Al等。
例如:Fe2O3 + 3CO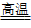 2Fe + 3CO2(炼铁); Cr2O3+2Al
2Fe + 3CO2(炼铁); Cr2O3+2Al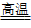 2Cr + Al2O3(制高熔点的金属)
2Cr + Al2O3(制高熔点的金属)
07.热分解法:适用于冶炼在金属活动顺序表中,位于氢之后的金属(如Hg、Ag等)。
例如:2HgO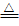 2Hg
+ O2↑ ;2Ag2O
2Hg
+ O2↑ ;2Ag2O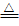 4Ag + O2↑
4Ag + O2↑

- 全部评论(0)
