有关酸碱性概念的归纳
时间:2021-08-16 12:06 来源:化学原理补正 作者:伍伟夫 点击: 次 所属专题: 溶液酸碱性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
“酸碱性”概念是一个十分重要的,且有多重含义的化学概念。为了使学生能较好地区分“物质酸碱性”与“溶液酸碱性”概念上的不同,有必要在教学中归纳和总结出如下几点,以便让学生对其能有一个更为清楚的认识。
一、物质的酸碱性
酸与碱恐怕是人们最早认识的两类化学物质了。对那些挥发性酸,人们很远就可以闻到其刺激性气味,对不挥发性酸来说,也可以尝到其酸的味道。对于碱的溶液,则是在人用手指去接触时,会有一种滑腻的感觉。酸与碱间一个最为重要的反应就是,相互间可以“中和”而得到盐和水。这样,原有的酸和碱的性质就都消失了。
只是在从组成上来对物质进行研究及分类后,人们才认识到,要从电离时所生成的离子的种类来看问题。并规定电离时所生成的阳离子全部都是氢离子的电解质才是酸……。并把常见的化合物分成了氧化物,及碱、酸、盐这样的几类物质。
这就是初中化学中给出的化学物质分类体系。而酸碱性也成了其中一个重要的分类标准。
酸碱性的含义在氧化物的分类中体现的是最为明显的。即,能与酸反应的是碱性氧化物,能与碱反应的是酸性氧化物。
只有这样,氧化物的分类才能顺理成章地成为如下的这样一张表。
分类 | 物质 | 与酸反应 | 与碱反应 | 组成(多为) |
酸性氧化物 | SO3、P2O5、CO2、SiO2 | 不能 | 能 | 非金属氧化物 |
碱性氧化物 | Na2O、CaO、FeO、CuO | 能 | 不能 | 金属氧化物 |
两性氧化物 | Al2O3、ZnO | 能 | 能 | 金属氧化物 |
不成盐氧化物 | CO、NO | 不能 | 不能 | 非金属氧化物 |
也就是说,物质的酸碱性,应该从化学性质的角度来理解。物质的酸碱性是其所具有的一种化学性质。它不等同于酸类物质的的通性,也不等同于碱类物质的通性。
当人们从化学组成的角度来看盐——这样的一类物质时,相对于被完全中和的正盐,还有一类酸碱间不完全中和的产物存在。即,在其盐中还保留一些H+离子的被称为是酸式盐(如NaHCO3)。反之,还保留一些OH-离子的被称为是碱式盐(如Cu2(OH)2CO3)。
这就使人们,要分别来对待及讨论这两类盐的酸碱性了。
酸式盐多是可溶性的。除了二元强酸H2SO4的酸式盐(如NaHSO4)仍保留有酸性外(因HSO4-离子仍有很强的解离趋势)。其余的酸式盐,从化学性质的角度来看,都属于两性的物质的范畴。即,它们既可以与酸反应,也可以与碱反应。
如,NaHCO3+HCl=NaCl+H2O+CO2↑,
NaHCO3+NaOH=Na2CO3+H2O。
碱式盐一般是不溶性的。所以它们的碱性要以与酸反应的形式来加以体现。
如,Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑。
也就是说,碱式盐有碱性,而不具有酸性。从类别上看,它应该属于碱性物质。
总之,物质的酸(碱)性指的就是,它能否与碱(酸)反应,这样的一种性质。
二、溶液的酸碱性
在中学化学教学中不但提到了溶液的酸碱性,还提到了溶液酸碱性强弱的程度,即溶液的酸碱度。
从水的自偶电离不难知道,水溶液的酸碱性是与溶液里H+和OH-离子的浓度有关的一个溶液的性质。这个性质并不一定非要通过化学变化才能表现出来。所以,从本质上来说它是一个物理性质。如,人们是有可能单凭手指的滑腻感程度来区分两个酸碱性相差十分明显的溶液。
在化学上,溶液酸碱性强弱,一般情况下可定量地用pH值反映出来。
对简单的已知组成的溶液,可以从理论上计算出其pH值。
在实践上则可以使用pH试纸或利用酸度计(pH计),来确定和验证溶液的pH值。
所谓溶液的酸(碱)性,指的就是水溶液的pH值,是大于7、还是小于7,这样的一种性质。
比较麻烦的是溶液的酸碱性,并不都是与物质的酸碱性类别完全对应的。
如,一些难溶酸(H2SiO3)或难溶碱(Cu(OH)2),就不能使其所处的水溶液体系,表现出酸性或碱性,也就是说它们不能影响溶液的pH值。
对氧化物来说也是这样来判断的。首先要看它们是否能与水发生反应,其次看这个氧化物的水化物是否溶于水(这两点通常会是一致的)。
用这个标准来衡量的,就可以得出两条结论:
在常见的非金属氧化物中,除了不成盐的CO和NO,及不与水反应的SiO2以外,其余的都可以与水反应并使水溶液呈酸性。
作为典型金属的ⅠA与ⅡA元素,其氧化物都是碱性氧化物。也就是说这些氧化物都可以与水反应,且能使水溶液呈碱性。连MgO也不例外(尽管Mg(OH)2很难溶,但其溶解的那一极小部分也足以使酚酞指示剂变红)。
对于盐溶液的酸碱性,那就要复杂一些了。同样要考虑其溶解性。因为难溶的盐是给不出多少金属离子及酸根离子的。
这样看,由于所有碱式盐都难溶,就应排除在对溶液酸碱性有影响的讨论之外(呈中性)。凡是难溶的正盐(AgCl、CaCO3)也应该排除在对溶液酸碱性有影响的讨论之外(也呈中性)。
在这个排除掉不溶性盐的基础之上,再从盐的组成角度来考虑问题,就要简单许多了。
对正盐来说,可以简单地从其组成来区分溶液的酸碱性。
这就是人们常说的,强酸强碱盐的水溶液呈中性,强酸弱碱盐显酸性,强碱弱酸盐显碱性。从水解的角度或据质子酸碱理论,都可以对这种现象进行更科学的解释。
对于弱酸弱碱盐来说就比较麻烦了。定性的讨论依据的是其碱常数及酸常数的相对大小。也就是说,其中的哪个更大了一些,它就能决定溶液的性质。
定量的讨论是:作为一个两性物质,其溶液中[H+]的计算公式应该为
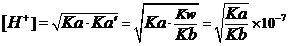
由此不难看出,弱酸弱碱盐溶液中的[H+],是由Ka与Kb的数值之比要大于1、还是小于1,来决定的。
由于多数酸式盐是可溶的,且他们也都属于两性物质,一般也要用上面的计算公式来计算(其中的Ka及Ka',就是相关联的两级电离常数)。
不难看出,只要该酸式盐中酸的连续相关两级酸常数有关系Ka∙Ka'>10-14,其溶液就会显酸性。反之,Ka∙Ka'<10-14,其溶液就会显碱性。
三、归纳物质和溶液酸碱性间关系的一张表
物质的酸碱性和溶液的酸碱性是两个内涵不同,但又有联系的概念。
下面把几类物质的酸碱性和溶液酸碱性列表归纳如下:
物质种类 | 物质酸碱性 | 水溶液酸碱性 | 关系 | 判别依据 | ||
氧 化 物 | 碱性氧化物 | 典型金属 | 碱性 | (反应后)碱性 | 一致 | ⅠA、ⅡA |
其余 | 碱性 | (不反应)中性 | 对应氢氧化物 不溶于水 | |||
两性氧化物 | 碱性、酸性 | (不反应)中性 | ||||
酸性氧化物 | 大部分 | 酸性 | (反应后)酸性 | 一致 | 对应酸可溶于水 | |
SiO2 | 酸性 | (不反应)中性 | 对应酸不溶于水 | |||
氢氧化物 | 典型金属 | 碱性 | 碱性 | 一致 | ⅠA、ⅡA | |
两性 | 碱性、酸性 | (不溶)中性 | 氢氧化物不溶 | |||
其余 | 碱性 | (不溶)中性 | ||||
酸 | 大部分酸 | 酸性 | 酸性 | 一致 | 酸可溶于水 | |
不溶性酸 | 酸性 | 中性 | 酸不溶于水 | |||
盐 | 正盐 | 强酸强碱 | 中性 | 中性 | 一致 | 酸与碱相对强弱的比较 |
强酸弱碱 | 酸性 | |||||
强碱弱酸 | 碱性 | |||||
弱酸弱碱 | 两性 | 不一定 | Ka1∙K'a1∽10-14 | |||
碱式盐 | 碱性 | (不溶)中性 | 均难溶 | |||
酸式盐 | NaHSO4 | 酸性 | 酸性 | 一致 | 二元强酸 | |
NaHCO3 | 两性 | 不一定 | Ka1∙K'a1∽10-14 | |||
可见,其中有相当一部分可以从酸或碱的溶解性来加以判断,还有一部分则要通过酸常数的比较来解决。掌握了这些,也就不难从物质类别的所属,来判断其在溶液中的酸碱性表现了。
四、元素的两性与两性金属
在有的无机化学教材中还提到了元素的两性。
一种分类依据的是,元素常见氧化物水合物的酸碱性。按照氧化物的水合物是酸、还是碱,将元素分为了成酸元素、成碱元素、两性元素和惰性元素(因时间太长,已记不起出处)。
按这种分类方法,两性元素并不是指其单质既能与酸反应,又能与碱反应。而只是用来描述其氧化物的水化物具有两性。
这里涉及的虽然是某化学物质的某具体化学性质,但是讨论的却是元素的类别。它与通常的物质酸碱性概念间是有很大区别的。
还有一种关系到物质类别的叙述为“锌与铍、铝相似,都是两性金属,能溶于强碱溶液中”。
这里的关于金属的“两性”就与“两性氧化物”中“两性”的含义完全相同了。指的是具体的化学物质,关系到的是能否与酸及碱反应,这样的化学性质。

- 全部评论(0)
