如何理解勒沙特列原理中的“压强”
时间:2019-11-27 18:31 来源:未知 作者:化学自习室 点击: 次 所属专题: 勒沙特列原理盲区
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、问题的提出
勒沙特列原理是化学平衡中的重要经验原理,也是高中阶段学生和教师解决化学平衡问题的主要依据。虽然有研究者认为勒沙特列原理只是经验性总结,只能定性判断,并且在实际应用中有条件限制(包括“均相、封闭体系、只允许一个因素改变等”),不建议向学生拓展和深入,但更多科学家高度赞美勒沙特列原理,认为其通俗易懂、简洁明了、应用广泛,与物理学中的“楞次定律”异曲同工,体现了平衡之美、科学之美。
因此,在高中阶段引导学生正确理解和应用勒沙特列原理具有重要意义。人教版高中化学选修4关于勒沙特列原理是这样描述的:在一个平衡体系中,如果改变影响平衡的一个条件(如浓度,压强或温度等),平衡就向能够减弱这种改变的方向移动。在实际教学中,笔者发现学生对浓度和温度带来的改变都能很好地做出判断,唯独对压强的理解存在很大的困难和误区。举一个简单的例子来说明:“恒温恒容条件下,在N2+3H2 2NH3可逆反应体系中,起始时通入1mol N2和3mol H2,一段时间后反应达平衡,此时再通入2molNH3,平衡如何移动?”。
2NH3可逆反应体系中,起始时通入1mol N2和3mol H2,一段时间后反应达平衡,此时再通入2molNH3,平衡如何移动?”。
学生往往会有两种理解,第一种:氨气浓度增大,平衡朝减少氨气浓度的方向移动,即平衡逆移;第二种:通入氨气后,容器压强增大,平衡朝气体系数减小的方向移动,即平衡正移。两种移动方向自相矛盾,学生出现的类似这种“弄混浓度与压强”的例子还有很多。
在笔者课堂中曾出现了学生互相说服不了彼此的情况,导致学生一度不敢用勒沙特列原理来判断平衡移动的方向。
如何化解学生对勒沙特列原理中“压强”理解的困难,更好地运用其解决化学平衡以及难度更大的等效平衡问题?笔者从教学实践出发,提出了自己的思考和尝试,希望对教师同行有所启发。
二、如何理解勒沙特列原理中的“压强”
1.在高中化学中讲授分压的概念
众所周知,“压强”比较抽象,不像浓度和温度那样直观,而学生对气体的描述更多是通过体积来衡量。但在混合气体中,气体体积是没有相对大小的。在化工生产实际中,气体的用量也不是通过体积来测量,而是通过调节气体管道的压强来实现,这就是为何历年的高考十分热衷考查气体压强(分压)及压强平衡常数。以全国I卷为例,2018年和2019年高考“化学反应速率与平衡”题目中,对学生理解压强及气体分压就提出了很高的要求。而高中化学教材限于篇幅,对气体分压没有展开介绍,以至于造成学生理解勒沙特列原理的困难。对此,笔者尝试在高一化学必修1“气体摩尔体积”章节里就提前讲述分压的概念,后来发现这批学生在后续勒沙特列原理的理解及难度更大的等效平衡的分析、压强平衡常数的计算中较往届学生都有很大的提升。因此,笔者认为在高中化学阶段让学生了解和掌握气体分压的概念很有必要。
勒沙特列原理中的“压强”包括两个方面的含义,一方面可以指分压,另一方面也可以指反应体系的总压。而学生之所以弄混浓度与压强的变化,关键就在于没有掌握分压的概念。而高中阶段涉及到的压强基本都是气体体系,因此分压基本指气体分压。气体分压指的是当气体混合物中的某一种组分在相同的温度下占据气体混合物相同的体积时,该组分所形成的压力。
如果将混合气体视为理想气体,则各气体组分的分子间没有相互作用力,互不干扰,混合气体的总压等于各组分的分压和,这就是道尔顿分压定律。根据理想气体状态方程可知:某一气体的分压=该气体在混合气体中的物质的量分数×总压。
上述例子中,达平衡后再通入氨气,既可以理解为氨气浓度增大,平衡逆移;也可以理解为氨气分压增大,平衡朝减少氨气分压的方向移动,即逆移。这样一来,浓度和分压就统一起来了。
概括地说,单一地增大某个气体的分压(浓度),虽然容器的总压增大,但不能理解为“增大压强”,因为反应体系中的其他气体分压并没有增大,只能理解为单个气体分压的改变,平衡朝该气体分压减少的方向移动。
而当压缩容器或按起始比例充入反应体系的各种气体时,根据PV=nRT可知,反应体系各种气体分压均按比例增大,此时便可以理解为反应体系总压增大,按照平衡的“弹簧反抗效应”,若要使反应体系的压强减小,则需要往气体物质的量减小的方向移动,与勒沙特列原理相吻合。
当然有学生会问到,如果不按比例充入反应体系各组分气体时该如何判断?此时无法依据勒沙特列原理直接判断,只能根据Q与K的关系进行分析,这也是勒沙特列原理的局限,只能改变影响平衡的一个条件。
2.利用分压解决“充惰性气体时平衡移动方向”的问题
我们还可以用分压来解决“充惰性气体时平衡移动方向”的问题:如恒温恒容条件下,往合成氨平衡体系中充入一定量的稀有气体,根据分压定律可知P总=P(反应体系气体)+P(惰性气体),此时容器的压强即混合气体的总压增大,但N2、H2、NH3的物质的量不变,因而各自的分压、反应体系的气体压强并没有改变,增加的只是稀有气体的分压,和平衡体系无关,故平衡不移动。
类似地,恒温恒压条件下,往合成氨平衡体系中充入一定量的稀有气体,此时容器的压强(混合气体总压)保持不变,但容器体积扩大,根据理想气体状态方程PV=nRT可知,N2、H2、NH3的物质的量n不变,V扩大,分压P都按比例相应减少,相当于整个反应体系的压强减小,按照平衡的“弹簧反抗效应”,若要使反应体系的压强增大,则需要往气体物质的量增大的方向移动,符合勒沙特列原理。
显然,引入分压后,勒沙特列原理中的浓度和压强实现了统一,再不会自相矛盾,可以很好地回答平衡移动的方向。
3. 利用压强解决等效平衡的问题
在化学平衡中我们还经常遇到这样的问题:恒温恒容条件下,在N2+3H2 2NH3可逆反应体系中,起始时通入1molN2和3mol H2,一段时间后反应达平衡,此时再通入2molNH3,则再次达平衡时氮气的百分含量如何改变?面对类似的题目时,有不少教师习惯性地向学生解释:“通入氨气,压强增大,平衡正移,N2百分含量变小”,这也是不少习题辅导书上给出的参考答案,给学生带来了不少困惑。(正如刚刚前面才论述单一通入氨气不能理解为压强增大)
2NH3可逆反应体系中,起始时通入1molN2和3mol H2,一段时间后反应达平衡,此时再通入2molNH3,则再次达平衡时氮气的百分含量如何改变?面对类似的题目时,有不少教师习惯性地向学生解释:“通入氨气,压强增大,平衡正移,N2百分含量变小”,这也是不少习题辅导书上给出的参考答案,给学生带来了不少困惑。(正如刚刚前面才论述单一通入氨气不能理解为压强增大)
之所有会有上述错误的解释,是因为在教学中,很多学生甚至教师都会不自觉地将平衡移动和等效后的平衡混在一起。应当指出的是,平衡移动描述的是某一时刻反应进行的方向,而等效后的平衡衡量的是再次达到平衡后的结果,两者显然不同。
在上述例子中,平衡后再通入氨气,则氨气浓度(分压)增大,平衡一定是逆移的,但N2的百分含量却不一定增大,它取决于NH3转化为N2的程度与原平衡相比是否增大。
而教师和学生之所以会惯性地解释为“压强增大,平衡正移”其实是在运用等效平衡的思想,将充入氨气后的新体系在结果上进行了等效处理,可以用图示表示如下:
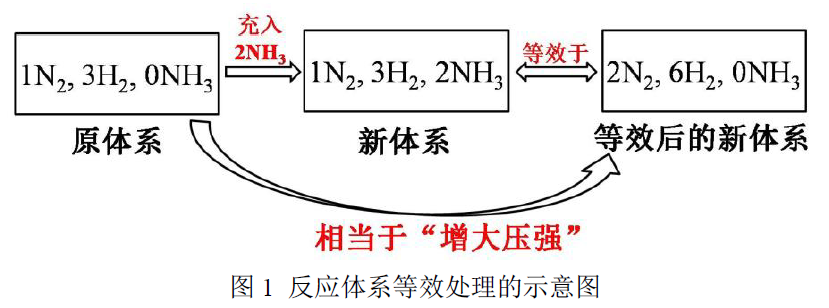
毫无疑问,在上述问题的解释上,我们不能表述为“压强增大,平衡正移”。因为“压强增大,平衡正移”的描述是我们针对上述示意图中原体系和等效后假想的新体系而言的。
但实际上,通入氨气后,平衡移动方向应该是针对原体系和新体系而言的,这两者明显不同,很容易弄混。
在教学的处理上,为了化解学生理解类似问题的困难,教师可以先引导学生认识“平衡移动方向”和“平衡移动结果”二者的不同。
通俗一点来说,“平衡移动”描述的是这一瞬间往哪边跑,而“平衡移动的结果”描述的则是最终跑了多远、跑到了哪里。有了这样的理解后,上述平衡问题我们便可以这样考虑:再通入氨气后,N2+3H2  2NH3平衡逆移,新反应体系“相当于”在更大的压强下进行NH3分解为N2和3H2的反应,由于压强相较原体系增大,不利于NH3转化为N2,因此N2百分含量下降。
2NH3平衡逆移,新反应体系“相当于”在更大的压强下进行NH3分解为N2和3H2的反应,由于压强相较原体系增大,不利于NH3转化为N2,因此N2百分含量下降。
这里的表述用“压强增大,不利于NH3转化为N2”比用“压强增大,平衡正移”显然更好理解也更为准确,才能让学生区分平衡移动方向和平衡移动结果的不同。
三、总结
勒沙特列原理在人教版教材中的描述寥寥数语,惜字如金,但其中包括的含义和解释却非常广泛,也正因此在教学中在学生带来了不少了困惑与误解,甚至有研究者指出勒沙特列原理对学生和教师理解化学平衡造成了负面影响,并倡议在高中化学教材中删除勒沙特列原理。
这样的观点未免过于极端。
化学学科本身的特点就是各种原理繁多,而每种原理好像又不能解决所有问题,但都不妨碍各种原理深入人心。勒沙特列原理同样如此。当我们理顺了影响化学平衡的条件,厘清平衡移动的本质,便能够准确地理解勒沙特列原理的内涵和使用范围。在高中阶段,学生运用勒沙特列原理基本可以回答生产生活中遇到的各类化学平衡问题,意义重大。
作为教师的我们,应当在自身深入理解勒沙特列原理的基础上,在教学中以学生的视角去思考和运用勒沙特列原理,并针对可能产生的误区想法设法地引导学生通俗易懂地理解,就如本文建议的:“提前讲述气体分压的概念,为后续知识奠定基础”。这种思考、探索与尝试本身就是我们作为化学教师不断进步、不断提升的动力和源泉。

- 全部评论(0)
(962462186) 评论 href="/plus/view.php?aid=17699">如何理解勒沙特列原:妙不可言,爱了爱了
(3047531663) 评论 href="/plus/view.php?aid=17699">如何理解勒沙特列原:太牛了,解决了我很久的疑惑,感谢
