铝与酸或碱反应生成H2的量的关系
时间:2019-12-25 09:35 来源:未知 作者:化学自习室 点击: 次 所属专题: 金属铝 金属与酸
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、方法介绍
2Al+6HCl===2AlCl3+3H2↑
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(1)等质量的铝与足量的盐酸、氢氧化钠溶液分别反应:
①产生H2的物质的量相等。
②消耗H+、OH-的物质的量之比为n(H+)∶n(OH-)=3∶1。
(2)足量的铝分别与等物质的量的HCl和NaOH反应:
①消耗Al的物质的量之比为1∶3。
②生成H2的物质的量之比为1∶3。
(3)一定量的铝分别与一定量的盐酸、氢氧化钠溶液反应:
若产生氢气的体积比为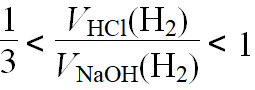 ,则必定
,则必定
①铝与盐酸反应时,铝过量而HCl不足。
②铝与氢氧化钠溶液反应时,铝不足而NaOH过量。
二、应用
甲、乙两烧杯中各盛有100mL3mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉的质量为________(填字母)。
A.5.4g B.3.6g C.2.7g D.1.8g
解析:其反应原理分别为2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑。可见当参加反应的HCl和NaOH的物质的量一样多时,产生H2的体积比是1∶3,而题设条件体积比为1∶2,说明此题投入的铝粉对盐酸来说是过量的,而对于NaOH来说是不足的。
2Al+6HCl=== 2AlCl3 + 3H2↑
6mol 3mol
3mol·L-1×0.1L 0.15mol
则Al与NaOH反应生成的H2为0.15mol×2=0.3mol。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2×27g 3mol
5.4g 0.3mol
即投入的铝粉为5.4g。

- 全部评论(0)
