铝盐与强酸强碱反应计算规律总结
时间:2022-05-09 08:16 来源:未知 作者:王利平 点击: 次 所属专题: 铝反应图像
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在涉及金属铝及其化合物的计算中,有一类重要的计算,就是铝盐溶液与强碱溶液、偏铝酸盐与强酸溶液的反应计算,这类计算有其特殊的计算关系和相应的图象。
一、铝盐与强碱互滴类
试剂滴加顺序 | 现象 | 反应离子方程式 | 图象 |
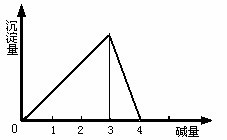
1.向AlCl3溶液中滴加NaOH溶液至过量
| 开始产生白色沉淀,不断增加到最大,又溶解消失。
| Al3++3OH―=Al(OH)3↓, Al(OH)3+OH-=AlO2-+2H2O |
|
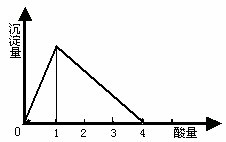
2.向NaOH溶液中滴加AlCl3溶液至过量
| 产生白色沉淀迅速消失,突然生成沉淀到最大值恒定。 | ⑴ Al3++4OH -=AlO2-+2H2O ⑵Al3++ 3AlO2-+6H2O = 4Al(OH)3↓ |
|
(1). 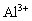 与NaOH生成沉淀规律:
与NaOH生成沉淀规律:
①当![]() 时,
时,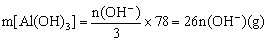 。
。
②当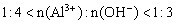 时,
时,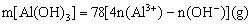 。
。
③当 时,
时,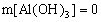 。
。
用数轴表示AlCl3溶液中滴加NaOH后铝的存在形式: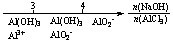
二、偏铝酸盐与盐酸互滴类
试剂滴加顺序 | 现象 | 反应离子方程式 | 图象 |
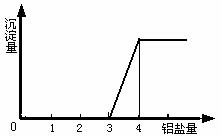
1.向NaAlO2溶液中滴加稀盐酸至过量
| 生成白色沉淀,增加到最大值,逐渐溶解消失。 | AlO2-+H++H2O=Al(OH)3↓,Al(OH)3+3H+=3Al3++3H2O |
|
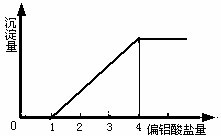
2.向盐酸中滴加NaAlO2溶液至过量
| 开始无沉淀,逐渐产生白色沉淀到最大值不变。 | AlO2-+4H+= Al3++2H2O,Al3++ 3AlO2-+6H2O =4Al(OH)3↓ |
|
(2) AlO2-与强酸(H+)生成沉淀计算规律:
(1) 当0<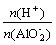 ≤1时,产生Al(OH)3沉淀,n[Al(OH)3]=n(H+)
≤1时,产生Al(OH)3沉淀,n[Al(OH)3]=n(H+)
(2) 1<![]() <4时,生成Al(OH)3部分溶解,n[Al(OH)3]=
<4时,生成Al(OH)3部分溶解,n[Al(OH)3]= 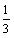 [4n ( AlO2-)-n (H+)]
[4n ( AlO2-)-n (H+)]
(3) 当 ![]() ≥4时,无Al(OH)3。
≥4时,无Al(OH)3。
3.向NaOH和NaAlO2溶液中滴加盐酸至过量
现象 :开始无沉淀,沉淀到最大值,后来全溶解。
三、混合铝盐溶液中滴加碱类
向盐酸和MgCl2、AlCl3混合溶液中不断滴加NaOH溶液至过量
结论 :溶液碱性逐渐增强,Mg(OH)2与强碱溶液共存,Al(OH)3不能。
离子方程式:H++OH-= H2O Mg2++2OH―= Mg(OH)2↓
Al3++3OH―=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
四、金属离子混合溶液加碱类
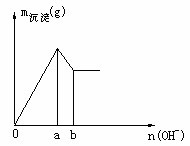
 混合溶液与OH-反应时,确定
混合溶液与OH-反应时,确定 物质的量。
物质的量。
若 与OH-反应关系如图,则
与OH-反应关系如图,则
①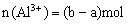 ②
② 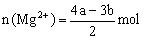
五、明矾与![]() 溶液反应类 明矾
溶液反应类 明矾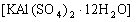 与
与![]() 溶液反应方程式:
溶液反应方程式:
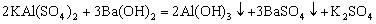
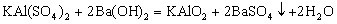
生成沉淀规律:①当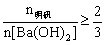 时,
时,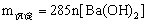 ;
;
②当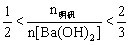 时,
时,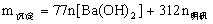 ;
;
③当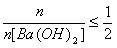 时,
时,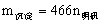 。
。
六、重要物质加入铝盐溶液类
Na、Na2O、Na2O2、SO3、NO2 等先与水反应,再与铝盐反应。
七、计算方法 1.公式法: 利用物质的量判断属哪类情况,对号入座求算。
2.守恒法:运用质量、电荷、电子守恒等思维,进行铝的计算。
3.对比法:根据所给数据,比对分析有关物质和过剩量物质,缜密思考。
4.比例法:找出铝及其化合物在反应中,物质的量、质量等存在的比例关系求。
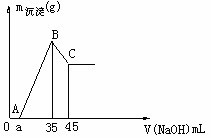
例1. 准确称取6g铝土矿样品(含 )放入盛有100mL某浓度的硫酸的烧杯中,充分反应后过滤,向滤液中加入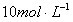 NaOH溶液,产生沉淀质量m与加入NaOH溶液体积V的关系。
NaOH溶液,产生沉淀质量m与加入NaOH溶液体积V的关系。
回答:
(1)硫酸物质的量浓度_______________。(2)若a=2.3,用于沉淀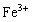 所消耗NaOH溶液体积是_________mL,矿中各组成成分质量分数:
所消耗NaOH溶液体积是_________mL,矿中各组成成分质量分数: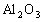 为_________,
为_________,![]() 为_________。
为_________。
解析:(1)样品只有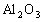 、
、![]() 与H2SO4反应。滤液:H2SO4、Al2(SO4)3、Fe2(SO4)3 ,加35mL NaOH时,沉淀值最大,此时沉淀为Al(OH)3、、Fe(OH)3 , 形成
与H2SO4反应。滤液:H2SO4、Al2(SO4)3、Fe2(SO4)3 ,加35mL NaOH时,沉淀值最大,此时沉淀为Al(OH)3、、Fe(OH)3 , 形成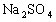 溶液,由电荷守恒
溶液,由电荷守恒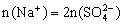 ,根据元素守恒知
,根据元素守恒知
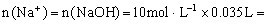
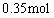
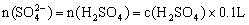 ,得
,得 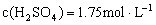
(2)沉淀Al3+消耗OH―量与溶解Al(OH)3所耗OH―比为3:1,沉淀Al3+所用NaOH溶液为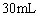 ;
; 耗用NaOH溶液:
耗用NaOH溶液: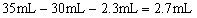 。
。
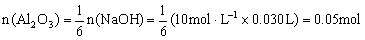
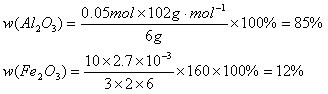
答案:(1)1.75 mol/L (2)2.7 ; 85% ; 12%
点评:考查铝盐与碱反应规律,图象关键点和守恒法运用。

- 全部评论(0)