银及其化合物性质总结
时间:2020-01-03 15:24 来源:未知 作者:化学自习室 点击: 次 所属专题: 银及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1. 银单质
(47Ag)是第五周期Ib族元素,在自然界有游离态的银。银的活动性在氢之后,在电化学中,Ag是活性电极,在阳极放电:Ag-e-=Ag+。
Ag2O对热不稳定,加热到时完全分解:
2Ag2O 4Ag+O2↑。
4Ag+O2↑。
乙醇在单质Ag或Cu催化下,可被氧化成乙醛,其催化原理是:
4Ag+O2 2Ag2O
2Ag2O
C2H5OH+Ag2O 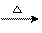 CH3CHO+2Ag+H2O
CH3CHO+2Ag+H2O
银器表面变暗,主要是由于生成了Ag2S所致,为使其表面恢复光泽,可将其放入盛食盐水的铝盆中,发生原电池反应:
负极(Al):2Al-6e-=2Al3+
正极(Ag2S):3Ag2S+6e-=6Ag+S2-,
S2-+2Al3++6H2O=2Al(OH)3↓+3H2S↑
总反应:2Al+3Ag2S+6H2O=2Al(OH)3↓+6Ag+3H2S↑
2.氢氧化银(AgOH)的性质
在AgNO3溶液中,逐滴加入稀氨水,首先生成白色沉淀AgOH↓,AgOH极不稳定,立即脱水生成暗棕色的Ag2O 沉淀,AgOH及Ag2O均能溶于氨水形成银氨溶液:
AgNO3+NH3·H2O=AgOH↓+NH4NO3
AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
3.银盐
多数银盐难溶于水,能溶的只有AgNO3、AgF、AgSO4等少数几种。
在卤化银中,除AgF外,AgCl(白↓)、AgBr(淡黄↓)、AgI(黄↓)均不溶于水且不溶于稀HNO3。
常见难溶银盐的溶解度大小为:S(AgCl)>S(AgBr)>S(AgI)>S(Ag2S)
依次加入Br-、I-、S2-可实现沉淀转化:AgCl→AgBr→AgI→Ag2S。
AgCl、AgBr、AgI都具有感光性。
照像底片及印相纸上都散布着细小的AgBr明胶,摄影时,受光线照射而分解成细小的银:
2AgBr 2Ag+Br2;
2Ag+Br2;
AgI可用于人工降雨。硝酸银见光或加热容易分解:
2AgNO3=2Ag+2NO2+O2↓
因此AgNO3晶体或溶液应装在棕色试剂瓶中。

- 全部评论(0)
