pH的计算方法与规律
时间:2020-02-16 11:14 来源:未知 作者:化学自习室 点击:次 所属专题: ph计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一.溶液pH的计算
1、基本思路
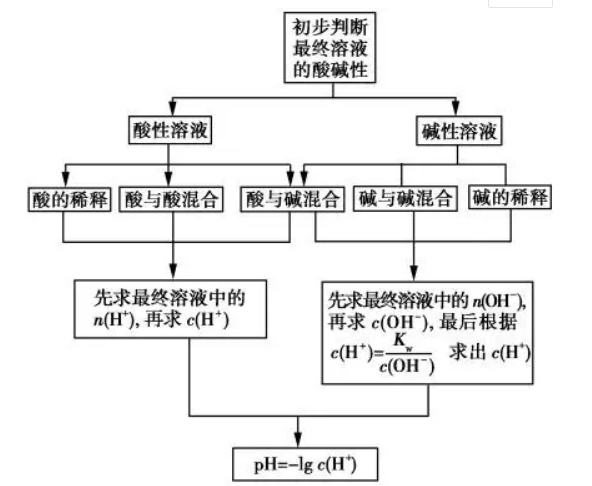
2、类型方法
①单一溶液
溶液类型 | 相关计算 |
强酸(HnA) | 设HnA的浓度为c mol/L,则c(H+)=nc mol/L,pH=−lgc(H+)=−lgnc |
强碱[B(OH)n] | 设B(OH)n的浓度为c mol/L,则c(OH−)=nc mol/L,c(H+)= mol/L,pH=−lgc(H+)=14+lgnc |
②混合溶液

二.酸碱混合的有关规律
1、等体积的强酸(pH1)与强碱(pH2)混合(25 ℃)
若混合前pH1+ pH2>14,则混合后溶液呈碱性,pH混>7;
若混合前pH1+ pH2=14,则混合后溶液呈中性,pH混=7;
若混合前pH1+ pH2<14,则混合后溶液呈酸性,pH混<7。
2、强酸(pH1)与强碱(pH2)混合呈中性时,二者的体积关系(25 ℃)
若pH1+ pH2=14,则V酸=V碱;
若pH1+ pH2≠14,则
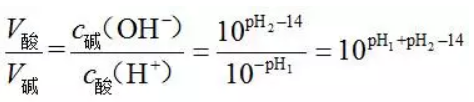 。
。
3、等体积的强酸(pH1)与弱碱(pH2)混合(25 ℃),若pH1+ pH2=14,由于弱碱过量,pH混>7。
4、等体积的弱酸(pH1)与强碱(pH2)混合(25 ℃),若pH1+ pH2=14,由于弱酸过量,pH混<7。
注意事项
(1)一般情况下,若ΔpH(pH的差值)≥2的两种强酸溶液等体积混合,pH=pH小+0.3;若ΔpH≥2的两种强碱溶液等体积混合,pH=pH大−0.3(相当于把pH小的酸溶液或pH大的碱溶液稀释到了原来的2倍)。
(2)酸按酸,碱按碱,同强混合在之间;异强混合看过量。若是碱碱混合或者酸碱混合且碱过量,一定要先算c(OH−),再算c(H+)及pH,或先算c(OH−),再算pOH、pH。
三、溶液稀释时pH的变化规律
1.常温下酸、碱的稀释规律
溶液 | 稀释前溶液pH | 加水稀释到体积为原来的10n倍 | 稀释后溶液pH | |
酸 | 强酸 | pH=a | pH=a+n | |
弱酸 | a<pH<a+n | |||
碱 | 强碱 | pH=b | pH=b−n | |
弱碱 | b−n<pH<b | |||
注:表中a+n<7,b−n>7。
2.酸、碱的无限稀释规律
常温下任何酸或碱溶液无限稀释时,溶液的pH都不可能大于7或小于7,只能接近7。
注意:
(1)对于pH相同的强酸和弱酸(或强碱和弱碱)溶液稀释相同的倍数,强酸(或强碱)溶液的pH变化幅度大。这是因为强酸(或强碱)已完全电离,随着加水稀释,溶液中的H+(或OH‒)的数目(水电离出的除外)不会增多,而弱酸(或弱碱)随着加水稀释,电离平衡向右移动,溶液中H+(或OH‒)的数目还会增多。将pH相同的强酸和弱酸稀释后pH仍相同,则弱酸中所加的水比强酸中的多
(2)对于物质的量浓度相同的强酸和弱酸(或强碱和弱碱),稀释相同的倍数,pH的变化幅度不同,强酸(或强碱)稀释后pH的变化幅度大。

- 全部评论(0)
