关于pH计算与测定的问题讨论
时间:2021-10-29 15:10 来源:未知 作者:王笃年 点击: 次 所属专题: ph计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
问题1、不同pH溶液混合时,计算混合液的pH何时以H+为准,何时以OH-为准?
请看如下实例:把pH=13和pH=11的烧碱溶液等体积混合,求混合溶液的pH。
解法1:混合溶液的
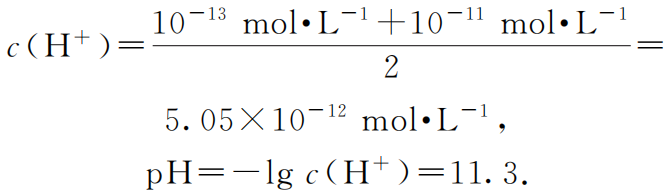
解法2: 两溶液的c(OH-)分别为10-1mol·L-1和10-3mol·L-1.
混合溶液的
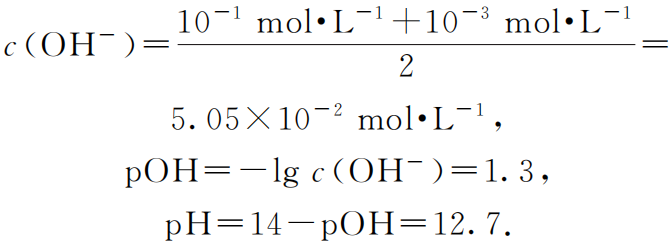
哪一个结果是正确的呢?pH=13的溶液碱性较强,现在我们假设不用pH=11的碱溶液与它混合,只用等体积的水来稀释这份pH=13的强碱溶液。显然,稀释后,溶液的浓度减半,c(OH-)=0.05moL·L-1,其pH=14-pOH=14-[-lgc(OH-)]=12.7。该计算结果可以说明,解法2的结果是正确的。
所以我们说,酸与酸混合时,计算pH应该以H+为准;而碱与碱溶液混合时,计算pH应该以OH-为准。
问题2、测定pH时若发现试纸颜色处于3和4之间,怎么读数?
pH试纸分多种,最为常用的是“广泛pH试纸”,它的标准比色卡只有1~14共14个色块,所以只能粗略测量到1个单位。当pH试纸变色后,颜色介于3、4之间时,并不可以随意读出3.5之类的数据,因为pH与c(H+)之间是指数函数关系,3.5不见得比3或4更靠近真实的值。那么,到底读3还是读4呢?
这是你的权力,你可以努力辨认该颜色到底更靠近标准色块里3的颜色还是4的颜色,然后决定记录3或者4。若一定要测量pH到小数点后一位,你可在此基础上,选用pH范围在2~4或3~5的精密pH试纸,对其再行测量。精密pH试纸一般有20个标准色块,分别对应于0.1个单位的pH。
问题3、可否使用滴管取溶液测pH?
不能!为什么呢?试想你使用的滴管是干净的吗?不一定,那么,需要先洗涤该滴管,这样滴管里面就被水润湿了,用这样的滴管取待测液,待测液必然被稀释,所测pH也就不准确了。
当然,大家或许会说,再把滴管弄干燥不就可以了吗?那多麻烦啊!与其如此费劲,不如直接就用干燥洁净的玻璃棒了。
问题4、具有漂白性溶液的pH如何测得?
从氯水、漂白粉溶液等的实际实验看,这些具有漂白性溶液的pH,是可以使用试纸测定的。虽然在显示pH后,试纸的颜色最终会褪去,但毕竟试纸褪色需要一定的时间,给我们留出了读取pH的时间。
有人提出,既然试纸会因漂白褪色,那能不能使用pH计测量这些具有强氧化性溶液的pH呢?请参考下一问题。
问题5、pH计的工作原理是什么?
pH计是依据pH对特定电极的电极电势的影响而设计的,仪器显示的pH数据,实际是由电池电压转化而来的.举例说明如下:大家都知道,酸性KMnO4溶液的氧化性比非酸化的KMnO4要强,这是为什么呢?因为H+参与了MnO4- 被还原的过程:MnO4- +5e-+8H+=Mn2++4H2O,其浓度对MnO4-/Mn2+这个“电对”的电势(电极电势标志着“电对”中氧化态MnO4- 的氧化性强弱)具有直接影响,H+浓度越高,对应MnO4-/Mn2+电对的电位就越高.
pH计从设计原理上看,实际就是一个微型的化学电池,由测量电极和参比电极构成,参比电极的电位是恒定不变的,它不受环境pH的影响,而测量电极的电位则随溶液pH的变化而发生比较敏锐的变化.测量时,将仪器浸入待测液内,仪器首先测得两极间电压,再依据电池固有参数和有关转化公式(能斯特方程式)把两极间的电压自动转换为pH显示在屏幕上.
鉴于以上分析可知,使用pH计测量强氧化性溶液的pH,往往会发生较大的偏差,因为强氧化性的溶液会严重影响测量电极的电极电位。不只pH计,很多便携式的手持设备,如检测酒精含量的酒驾鉴定仪、血糖测量仪等,也是采取电化学原理设计的。

- 全部评论(0)
