化学平衡题常用的几种解法
时间:2020-02-16 10:42 来源:未知 作者:化学自习室 点击: 次 所属专题: 化学平衡解题思维
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、特征法
对题干和选择支的特点进行分析,发现隐含信息,得出正确判断的方法。
例1.在一个不导热的密闭反应器中,只发生两个反应: a(g)+b(g) 2c(g);△H<0 x(g)+3y(g)
2c(g);△H<0 x(g)+3y(g) 2z(g);△H>0,进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是
2z(g);△H>0,进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
解析:看题设的特征再看选项,题设不导热的密闭反应器,选项研究恒容和恒压下的变化,这与反应物与生成物的聚集状态和化学计量数有关,前一个反应化学计量数不变,压强对它没有影响,等压时,通入惰性气体,相当于减压,后一反应平衡向逆反应方向移动,放出热量温度升高,前一反应平衡向逆反应方向移动,c的物质的量变化。答案(A)。
二、假设法
当某一可变因素的存在形式限定在有限种可能时,假设该因素处于某种情况,并以此为条件进行推理。
例2.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g);ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g);ΔH=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
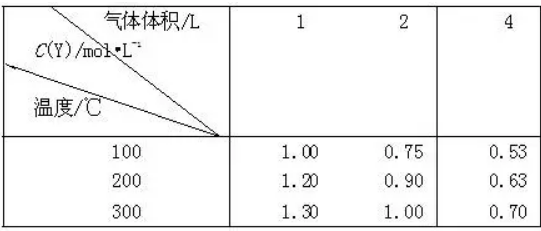
下列说法不正确的是
A.m<n
B.Q<0
C.温度不变,压强增大,Y的质量分数减小
D.体积不变,温度升高,平衡向正反应方向移动
解析:横向观察表中数据可知,当温度不变,将容积的体积扩大1倍时,假设平衡不移动应该为0.5mol/L、0.6mol/L、0.65mol/L,而平衡后的生成物Y的浓度大于原来的1/2,说明降低压强平衡向正反应方向移动,即m小于n。增大压强平衡向逆反应方向移动,生成物Y的质量分数减小;纵向观察表中数据可知,当压强不变时,升高温度,生成物Y的浓度是增大的,说明升高温度平衡向正反应方向移动,则反应是吸热反应,即Q大于0。答案(B)。
三、比较法
有比较才有鉴别,对比各个事物或现象,以揭示它们之间共同点和差异点的思维方法,解题过程是寻找联系和区别的过程。
例3.相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
A.X的转化率为:甲<丙<乙<丁
B.X的转化率为:甲<乙<丙<丁
C.Y的转化率为:甲>丙>乙>丁
D.Y的转化率为:丁>乙>丙>甲
解析:将起始时情况作如下排列:
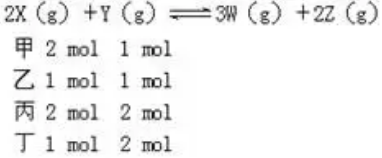
甲与乙比较,甲相当于在乙的基础上再增加X的物质的量,甲中Y的转化率大于乙中Y的转化率,但X的转化率要小于乙中X的转化率;同理分析甲和丙,相当于在甲的基础上再增加Y的物质的量,丙中X的转化率大于甲中X的转化率,但Y的转化率要小于甲中Y的转化率;同理分析乙和丁,丁相当于在乙的基础上再增加Y的物质的量,丁中X的转化率大于乙中X的转化率,但Y的转化率要小于乙中Y的转化率;乙和丙比较,相当于在增大压强。由于正方应是体积增大的可逆反应,所以平衡向逆反应方向移动,因此X或Y转化率均降低;故X的转化率甲<丙<乙<丁,同理得Y的转化率:丁<丙<乙<甲,答案(A)。
四、极端法
将研究的对象或过程向极端状态进行分析,使因果关系变得明显,从而使问题得以解决。
例4.在密闭容器中进行X2(g)+4Y2(g) 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别是0.1mol·L-1、0.4mol·L-1、0.2mol·L-1、0.3mol·L-1当反应达到平衡后,各物质的物质的量浓度不可能是
A.c(X2)=0.15 mol·L-1
B.c(Y2)=0.9 mol·L-1
C.c(Z2)=0.3 mol·L-1
D.c(Q2)=0.5mol·L-1
解析:可逆反应的特点是给定条件下反应进程的限度性,所以反应物和生成物的浓度不可能是0,将反应物X2、Y2按化学计量数全部转化为Z2、Q2,Z2、Q2分别为0.2mol·L-1、0.3mol·L-1,再加上原有的浓度,Z2、Q2的极限浓度是0.4mol·L-1、0.6 mol·L-1,同理将产物Z2、Q2按化学计量数全部转化为X2、Y2,X2、Y2分别为0.1mol·L-1、0.4mol·L-1, 再加上原有的浓度,X2、Y2的极限浓度是分别为0.2mol·L-1、0.8mol·L-1, c(Y2)=0.9 mol/L已超过极限浓度,答案(B)。
五、估算法
由于条件限制,无法(有时也没必要)进行精确地运算和判断, 而只能依赖于估算。 实质上是一种快速的近似计算, 它的基本特点是对数值作适当扩大或缩小,从而对运算结果确定一个范围,或做出一个估计。
例5.将1mol CO(g)和1mol H2O(g)充入某固定容积的反应器中,在一定条件下CO(g)+ H2O(g)  CO2(g)+ H2(g)达到一定反应限度时有2/3的CO转化成CO2,在相同条件下,将1mol CO(g)和2mol H2O(g)充入同一反应器中,当反应达到同一反应限度时,混合气体CO2的体积分数可能是
CO2(g)+ H2(g)达到一定反应限度时有2/3的CO转化成CO2,在相同条件下,将1mol CO(g)和2mol H2O(g)充入同一反应器中,当反应达到同一反应限度时,混合气体CO2的体积分数可能是
A.22.2%
B.28.2%
C.33.3%
D.37.8%
解析:因反应前后气体化学计量数没有变化,无论如何进行总物质的量是不变的,由于反应的可逆性和移动性,生成的CO2 最多不能达到1mol,最少不低于2/3,CO2的体积分数介于2/9—1/3之间。答案(B)。
六、差量法
依据化学反应前后气体物质的量之差,与反应物或生成物的变化量成正比而建立的一种解题方法。正确找出“理论差量”,是“差量法”的解题关键。反应前后存在差量,且此差量易求出是使用差量法的前提。
例6.一定条件下,合成氨气反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是
A.16.7% B.20.0% C.80.0% D.83.3%
解析:设达到平衡后混合气体的体积为1L,则其中生成的氨气的体积1L×20.0%=0.2L。根据反应的方程式:
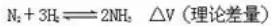

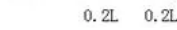
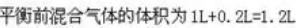
反应后气体体积缩小率
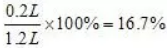
答案(A)。
七、三段法
化学平衡计算的一般格式,根据题意和恰当的假设列出起始量、转化量、平衡量。
例7.一定温度下,反应2SO2+O2  2SO3,达到平衡时,n(SO2)︰n(O2)︰n(SO3)=2︰3︰4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3,达到平衡时,n(SO2)︰n(O2)︰n(SO3)=2︰3︰4。缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是
A. 0.4mol
B. 0.6mol
C. 0.8mol
D. 1.2mol
解析:原平衡体系中SO2、O2、SO3的物质的量分别为2a、3a和4a,缩小体积平衡向右移动,O2的转化量为x
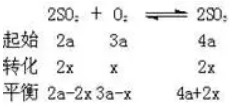
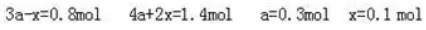
再次达到平衡时,n(SO2)=2×0.3mol-2×0.1mol=0.4mol。答案(A)。
八、整体法
整体法研究化学问题时,暂且避开局部细节或单个因素的纠缠,将需要解决的问题看作一个整体,通过研究问题的整体形式或整体结构作某种整体处理。
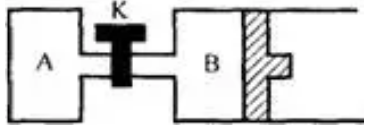
例8.如图所示,当关闭K时,向A中充入1mol N2、3mol H2,向b中充入2mol N2、6mol H2,起始时,V(A)=V(B)=aL。在相同温度和催化剂存在的条件下,两容器中各自发生下列反应:N2(g)+3H2(g) 2NH3(G)ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8aL。
2NH3(G)ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8aL。
请回答:
打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为 (用含a的代数式表示,连通管中气体体积忽略不计)。
解析:关闭K时A为恒容,B为恒压,打开K时可容器A、B看作整体,利用B为恒压的处理方式,B中充入2mol N2、6mol H2共8 Mol,达到平衡(Ⅰ)时,V(B)=0.8aL ,
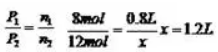
,平衡时总体积1.2L,减去V(A)=aL,得B的体积0.2aL。
九、图示法
由题目条件作出符合题意的图形,借助图形的直观性,经过简单推理或计算,从而得到答案的方法。
例9.已知2SO2 (g) + O2 (g)  2SO3 (g);ΔH=-197 KJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3 (g);ΔH=-197 KJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙> 2P乙
B.SO3的质量m:m甲=m丙> 2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙> k乙
D.反应放出或吸收热量的数值Q:Q甲=G丙> 2Q乙
解析:
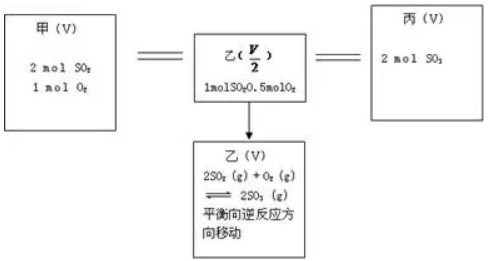
通过体积放缩构建等同平衡,改变体积观察平衡的移动得出结论。A P甲<2P乙,B m甲>2m乙,C K甲=K乙,D Q甲=197-Q丙> 2Q乙。答案(B )。
十、验证法
从题的正面解决困难时,将选项或特值逐一代入题干进行检验,看是否合适。
例10.甲、乙两容器都发生反应 2A(g)+ B(g ) xC(g),两容器温度和初始压强都相同。甲容器中充入 2 molA 和 1 molB,达平衡后,C 在平衡混合气中的体积分数为φ、物质的量为 n1;乙容器中充入 1.4 molA,0.7 molB 和 0.6 molC,达平衡后 C 在平衡混合气中的体积分数为φ、物质的量为 n2。下列说法中正确的是
xC(g),两容器温度和初始压强都相同。甲容器中充入 2 molA 和 1 molB,达平衡后,C 在平衡混合气中的体积分数为φ、物质的量为 n1;乙容器中充入 1.4 molA,0.7 molB 和 0.6 molC,达平衡后 C 在平衡混合气中的体积分数为φ、物质的量为 n2。下列说法中正确的是
A.若甲、乙两容器均为恒容容器,则 x必等于 2
B.若甲、乙两容器均为恒压容器,则 x必等于 3
C.若甲为恒压容器、乙为恒容容器,且 x≠3,则 n1必大于 n2
D.若甲为恒容容器、乙为恒压容器,且 x= 3,则 n1必大于 n2
解析:选项中x有两个值2和3,分别代入考虑。恒温恒压下,对x为任何值,两者均为等效平衡,达到平衡时,C的体积分数均相等,B选项错误;x=2甲、乙两容器均为恒容时,平衡混合气中C的体积分数相等,乙容器中充入起始A和B物质的量必须是2 mol、1 mol,0.6 molC转化到左侧,1.4 molA+0.6 molA=2 molA,0.7 molB+0.3molB=1 mol B,x=3反应前后化学计量数相等,压强对反应没有影响,只要投料A、B物质的量之比符合1:2就满足C的体积分数均相等,(1.4 molA+1.2mol/3A):(0.7 molB+0.6 mol/3 molB)=2:1,A选项错误;x≠3,甲、乙两容器一个保持等压、一个保持等容(不考虑温度变化),假设x=2,反应后化学计量数减小,甲和乙投料相同但甲为保持压强不变,相当于乙的加压过程,平衡移动,C的体积分数不可能相同,与题干矛盾;D选项x= 3反应前后化学计量数相等,0.6 molC转化到左侧,相当于1.8molA 、0.9molB,甲乙容器物质的量成正比,n1必大于 n2;答案(D)。

- 全部评论(0)
