压强平衡常数Kp的计算方法
时间:2020-12-17 16:14 来源:未知 作者:化学自习室 点击: 次 所属专题: 压强平衡常数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.Kp的含义:
在化学平衡体系中,各气体物质的分压替代浓度,计算的平衡常数叫压强平衡常数。单位与表达式有关。
2.计算技巧:
第一步,根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度;
第二步,计算各气体组分的物质的量分数或体积分数;
第三步,求出各气体物质的分压,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数);
第四步,根据平衡常数计算公式代入计算。
例如,N2(g)+3H2(g)![]() 2NH3(g),压强平衡常数表达式为
2NH3(g),压强平衡常数表达式为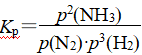 。
。
[典例导航]
(2018·全国卷Ⅰ,改编)F.Daniels等曾利用测压法在刚性反应器中研究了25 ℃时N2O5(g)分解反应:
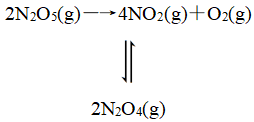
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如表所示[t=∞时,N2O5(g)完全分解]:
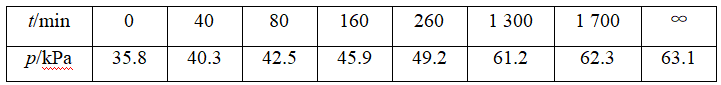
已知:2N2O5(g)===2N2O4(g)+O2(g) ΔH=-4.4 kJ·mol-1
2NO2(g) ![]() N2O4(g) ΔH=-55.3 kJ·mol-1
N2O4(g) ΔH=-55.3 kJ·mol-1
(1)若提高反应温度至35 ℃,则N2O5(g)完全分解后体系压强p∞(35 ℃)________63.1 kPa(填“大于”“等于”或“小于”),原因是_________。
(2)25 ℃时N2O4(g) ![]() 2NO2(g)反应的平衡常数Kp=________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=________kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
[思路点拨]
(1)①2NO2(g) ![]() N2O4(g) ΔH=-55.3 kJ·mol-1→升高温度、平衡左移→气体增多→刚性(恒容)反应器压强增大,
N2O4(g) ΔH=-55.3 kJ·mol-1→升高温度、平衡左移→气体增多→刚性(恒容)反应器压强增大,
②温度越高压强越大,根据①②分析可知p∞(35 ℃)>63.1 kPa。
(2)恒温恒容反应器,物质的量之比等于压强之比,可用分压表示组分的物质的量。N2O5完全分解生成N2O4和O2,起始pN2O5=35.8 kPa,其完全分解时pN2O4=35.8 kPa,pO2=17.9 kPa,设25 ℃平衡时N2O4转化了x,则
N2O4(g)![]() 2NO2(g)
2NO2(g)
平衡 35.8 kPa-x 2x
35.8 kPa-x+2x+17.9 kPa=63.1 kPa,
解得x=9.4 kPa。然后求pN2O4和pNO2最后代入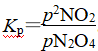 。
。
答案:(1)大于 温度升高,体积不变,总压强提高;NO2二聚为放热反应,温度升高,平衡左移,体系物质的量增加,总压强提高 (2)13.4
![]()
(1)25 ℃时2NO2(g) ![]() N2O4(g)的Kp为________。
N2O4(g)的Kp为________。
(2)对于N2O4(g) ![]() 2NO2(g)反应达到平衡时Kp(35 ℃)________Kp(25 ℃)(填“>”、“<”或“=”)。
2NO2(g)反应达到平衡时Kp(35 ℃)________Kp(25 ℃)(填“>”、“<”或“=”)。
答案:(1)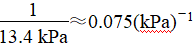 (2)>
(2)>
[对点训练]
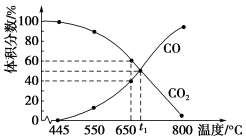
1.一定量的CO2与足量的C在恒压密闭容器中发生反应:C(s)+CO2(g) ![]() 2CO(g) ΔH=+173 kJ·mol-1,若压强为p kPa,平衡时体系中气体体积分数与温度的关系如图所示,回答下列问题:
2CO(g) ΔH=+173 kJ·mol-1,若压强为p kPa,平衡时体系中气体体积分数与温度的关系如图所示,回答下列问题:
(1)650 ℃时CO2的平衡转化率为________。
(2)t1 ℃时平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);该温度下达平衡后若再充入等物质的量的CO和CO2气体,则平衡________(填“正向”“逆向”或“不”)移动,原因是__________。
解析:

(2)t1℃时CO与CO2的体积分数相等,均为0.5,Kp=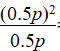 =0.5p(kPa)。
=0.5p(kPa)。
再充入等物质的量的CO和CO2时,二者的体积分数不变,平衡不移动。
答案:(1)25% (2)0.5p 不 再充入等物质的量的CO和CO2,平衡体系中二者的体积分数仍相同,平衡不移动
2.活性炭也可用于处理汽车尾气中的NO,在1 L恒容密闭容器中加入0.100 0 mol NO和2.030 mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
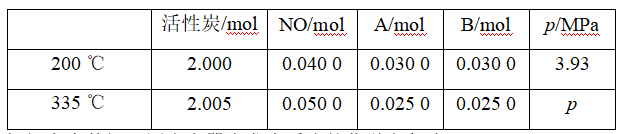
根据上表数据,写出容器中发生反应的化学方程式:____________,判断p________(选填“>”“<”或“=”)3.93 MPa。
计算反应体系在200 ℃时的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
解析:1 L恒容密闭容器中加入0.100 0 mol NO和2.030 mol固体活性炭,生成A、B两种气体,从不同温度下测得平衡体系中各物质的物质的量以及容器内压强数据可以看出:n(C)∶n(NO)∶n(A)∶n(B)=1∶2∶1∶1,所以可以推断出生成的A、B两种气体为N2和CO2,反应的化学方程式为C+2NO![]() N2+CO2。
N2+CO2。
该反应的平衡常数![]() ,容器的体积为1 L,平衡分压之比等于平衡浓度之比,带入表中数据计算得200 ℃时的平衡常数
,容器的体积为1 L,平衡分压之比等于平衡浓度之比,带入表中数据计算得200 ℃时的平衡常数![]() 。
。
答案:C+2NO![]() N2+CO2 >
N2+CO2 > 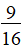
3.无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g) ![]() 2NO2(g) ΔH=+24.4 kJ·mol-1。
2NO2(g) ΔH=+24.4 kJ·mol-1。
上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为________(以k正、k逆表示)。若将一定量的N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=________kPa·s-1。
解析:上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,平衡时,v正=v逆,k正·p(N2O4)=k逆·p2(NO2),
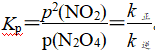 。
。
若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,

答案:![]() 3.9×106
3.9×106

- 全部评论(0)
