实验探究题知识积累
时间:2020-03-10 14:04 来源:未知 作者:化学自习室 点击: 次 所属专题: 探究实验
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
知识积累一:
常见离子及检验试剂及实验现象
NH4+
NaOH浓溶液
加热,生成有刺激性气味、能使湿润红色石蕊试纸变蓝的气体
Fe3+
KSCN溶液
溶液显血红色
Fe2+
KSCN溶液、氯水
加KSCN溶液没有现象、加氯水后出现血红色
Al3+
NaOH溶液
加入NaOH溶液生成白色沉淀,继续加入过量NaOH溶液白色沉淀溶解
Fe3+、Fe2+
KSCN溶液
出现血红色,证明含有Fe3+; KMnO4溶液 KMnO4溶液紫色消失,证明含有Fe2+
Fe3+、Al3+
KSCN溶液
出现血红色,证明含有Fe3+;加NaOH溶液过量,过滤,取上NaOH、HCl 层清液,逐滴加HCl至过量,先产生白色沉淀后溶解,证明含Al3+
Ag+
盐酸、稀硝酸
加入盐酸产生白色沉淀,该沉淀不溶液稀硝酸
Ba2+
稀盐酸、稀硫酸
加入稀盐酸无明显现象,加入稀硫酸后出现白色沉淀
CO32-
BaCl2溶液、稀盐酸
加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,放出无色无味气体
HCO3-
BaCl2溶液、稀盐酸
加入BaCl2溶液无白色沉淀生成,加入稀盐酸,放出无色无味气体
SO32-
BaCl2溶液、稀盐酸、品红溶液
加入BaCl2溶液后生成白色沉淀,沉淀溶于稀盐酸,并放出气体使品红褪色
HSO3-
BaCl2溶液、稀盐酸、品红溶液
加入BaCl2溶液后无白色沉淀生成,加入稀盐酸后,放出气体使品红褪色
SO42-
稀盐酸、BaCl2溶液
先加入过量稀盐酸,再加入BaCl2溶液生成白色沉淀
SiO32-
稀硝酸
加入稀硝酸生成白色沉淀
Cl-
AgNO3溶液、稀硝酸
加入稀硝酸酸化的AgNO3溶液生成白色沉淀
Br-
AgNO3溶液、稀硝酸
加入稀硝酸酸化的AgNO3溶液生成浅黄色沉淀;
氯水、CCl4
加入氯水后震荡,再滴入CCl4,分层,CCl4层呈橙红色
I-
AgNO3溶液、稀硝酸
加入稀硝酸酸化的AgNO3溶液生成黄色沉淀;
氯水、CCl4
加入氯水后震荡,再滴入CCl4,分层,CCl4层呈紫红色
ClO-
淀粉-KI溶液(HCl、紫色石蕊)
溶液变蓝色 (紫色石蕊先变红后褪色)
S2O32-
稀盐酸
既有黄色沉淀产生,又有刺激性气味气体生成
知识积累二:
一、晶体的获取和提纯:
1、获得单一稳定的溶质
(如从NaCl溶液中获得NaCl ):蒸发结晶 ( 蒸发至大部分晶体析出即停止加热)
2、获得易氧化、易分解、含结晶水的溶质
(如:莫尔盐中获得(NH4)2Fe(SO4)2)蒸发浓缩、冷却结晶、过滤、洗涤、干燥
(蒸发至溶液表面出现结晶膜即停止加热)
3、多种溶质获得溶解度变化小的(NaCl和KNO3混合溶液中获得NaCl)
蒸发结晶、趁热过滤、洗涤、干燥
4、多种溶质获得溶解度变化大的(NaCl和KNO3混合溶液中获得KNO3)
蒸发浓缩、冷却结晶、过滤、洗涤、干燥
5、趁热过滤的目的:防止溶液中其余溶质因冷却而析出。
(一般蒸发结晶后的过滤为趁热过滤,而冷却结晶后的过滤不用趁热过滤)
6、趁热过滤的操作:用事先预热的漏斗过滤;;或用事先预热的(布氏)漏斗抽滤
7、洗涤BaSO4沉淀(洗涤其它晶体也一样)
沿玻璃棒往漏斗中加洗涤剂(水)至完全浸没沉淀,待水自然流尽后,重复操作2-3次
8、检验沉淀(晶体)是否洗涤干净: (如BaSO4沉淀是否洗涤干净(BaCl2))
取少许最后一次洗涤液于试管中,滴加AgNO3,若未产生白色沉淀,则洗涤干净,若出现白色沉淀,则未洗涤干净
二、酸碱中和滴定和氧化还原滴定
9、滴定的步骤:
滴定管验漏--水洗涤--标准液润洗--加溶液--赶气泡--调节液面
10、滴定时的手和眼操作
一只手控制滴定管的活塞,另一只手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化
11、用KMnO4滴定草酸终点描述
当滴入最后一滴KMnO4溶液时,锥形瓶中溶液颜色由无色变为浅紫色,且半分钟内不褪色,即为终点
12、中和滴定一般选用酚酞或甲基橙做指示剂,不用石蕊做指示剂
13、如何排除碱式滴定管尖嘴中气泡:
将胶管弯曲使玻璃尖嘴向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出。
三、指示剂和试纸的使用
14、指示剂的变色:
石蕊试剂:本身为紫色 酸红碱蓝 酚酞试剂:本身无色 碱红酸不变
15、pH试纸检验溶液pH
取一段pH试纸放在玻璃片上,用干燥洁净的玻璃棒蘸取溶液,滴在pH试纸中间,待pH试纸变色后与标准比色卡对比
16、其余试纸的使用(检验气体): 如实验室制取氨气检验
取一段红色石蕊试纸,用蒸馏水水湿润,粘在玻璃棒一端,再送到管口进行检验。
四、气密性检验
17、分液漏斗型(起始端有活塞的)
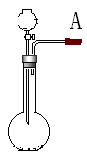
关闭分液漏斗的活塞,在a连接导管,导管一端插入水中,微热烧瓶,若导管口出现气泡,且冷却后导管内出现一段水柱并长时间不回落,则气密性良好,否则不是
18、长颈漏斗型(起始端无活塞后端有活塞或软管的)
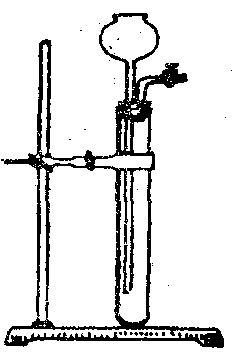
关闭活塞,往长颈漏斗中加水至浸末漏斗下端,若漏斗中液面高过试管中液面,且长时间保持,则气密性良好,否则不是
五、物质的干燥:
19、晶体的干燥和防止冷却吸水: 放在干燥器中
20、气体的干燥:
浓硫酸: 干燥酸性气体、中性气体(如SO2、Cl2、H2、O2等)
注意:
1、不可以干燥碱性气体和还原性气体(如NH3、H2S等)
2、用洗气瓶装,长进短出
碱石灰:干燥碱性气体、中性气体(如NH3、H2、O2等)
注意:
1、不可以干燥酸性气体(如Cl2、HCl等)
2、用球形干燥管或U形干燥管装,大口进小口出
CaCl2: 酸性碱性中性都可以
注意:不可以干燥NH3
六、其他:
21、用BaCl2溶液沉淀Na2SO4中SO42-,如何检验BaCl2是否过量(或检验沉淀完全)
取A中上层清液少许于试管中,滴加BaCl2溶液,若未出现沉淀,则沉淀完全,反之则未沉淀完全。
22、容量瓶验漏
往容量瓶中加入适量水,倒转容量瓶,观察是否漏水,若不漏水,正立容量瓶,将塞子旋转180度,再倒转容量瓶,若不漏水,则合格。
23、水浴加热的特点:受热均匀,易控制温度,且温度不超过100℃
24、用分液漏斗向容器中添加溶液:
打开分液漏斗上口的塞子,在旋开分液漏斗的活塞,慢慢滴加
注意:分液时下层液体从下口流出,上层液体从上口倒出,分清哪个在上层

- 全部评论(0)
