题型突破:化学原理简答题
时间:2020-03-26 13:18 来源:未知 作者:张劲辉 点击: 次 所属专题: 化学反应原理简答题
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
题空一 读懂图表 精准解答
1.图表题的审题要领
(1)看题干,明方向:看清题目要求,在题干中圈出关键词,明确是速率问题还是平衡移动问题,分清楚是“恒温恒压”还是“恒温恒容”,或其他限制条件。
(2)识图表,“面、点、线”
识图是解题的基础,①面即坐标系,明晰横、纵坐标所表示的化学含义,这是理解题意和进行正确思维的前提。明晰坐标含义,也就是用变量的观点分析坐标,找出横、纵坐标的关系,再结合教材,联系相应的知识点;②找点:找出曲线中的特殊点(起点、顶点、拐点、终点、交叉点、平衡点等),分析这些点所表示的化学意义以及影响这些点的主要因素及限制因素等,大多考题就落在这些点的含义分析上,因为这些点往往隐含着某些限制条件或某些特殊的化学含义;③析线:正确分析曲线的走向、变化趋势(上升、下降、平缓、转折等),同时对走势有转折变化的曲线,要分区段进行分析,研究找出各段曲线的变化趋势及其含义。
2. 气相平衡移动类简答题的答题模板
叙特点(反应特点或容器特点)―→变条件―→定方向―→得结论(或结果)
![]() 例2
例2![]() 在密闭容器中充入一定量H2S,发生反应2H2S(g)
在密闭容器中充入一定量H2S,发生反应2H2S(g) 2H2(g)+S2(g) ΔH=+169.8 kJ·mol-1。下图为H2S气体的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH=+169.8 kJ·mol-1。下图为H2S气体的平衡转化率与温度、压强的关系。
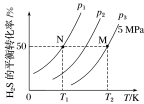
(1)图中压强(P1、P2、P3)的大小顺序为________,理由是________________。
(2)该反应平衡常数大小:K(T1)_____________(填“>”“<”或“=”)K(T2),理由是______________。
(3)如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有________________。
[解题思路]
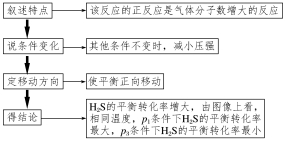
答案 (1)P1<P2<P3 该反应的正反应是气体分子数增大的反应,其他条件不变时,减小压强使平衡正向移动,H2S的平衡转化率增大,由图像上看,相同温度,P1条件下H2S的平衡转化率最大,P3条件下H2S的平衡转化率最小
(2)< 该反应正向是吸热反应,升高温度,平衡正向移动,平衡常数增大
(3)及时分离出产物
3.溶液中有关离子平衡的简答题思路
阅读题目情境的信息,找出核心问题的分析对象,即平衡体系;找出题目信息中与平衡体系变化的有关因素;利用平衡移动原理分析变化的因素对化学平衡移动的影响,即平衡移动方向的判断;说明平衡移动后对实际问题体系产生的影响。
一般用如下模式书写:“……存在……平衡,……(条件)使平衡向……(方向)移动,……(结论)”。
![]() 例3
例3![]() Na2HPO4是磷酸的酸式盐,但其水溶液呈碱性,从溶液中离子平衡角度分析回答下列问题:
Na2HPO4是磷酸的酸式盐,但其水溶液呈碱性,从溶液中离子平衡角度分析回答下列问题:
(1)解释Na2HPO4溶液呈碱性原因___________________。
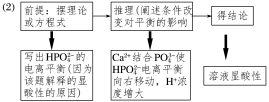
(2)当加入足量饱和CaCl2溶液时,溶液变为酸性,解释原因_______________。
[解题思路]
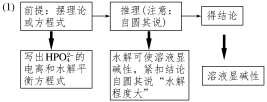
答案 (1)Na2HPO4溶液中存在两个平衡,一是电离平衡,HPO42- H++PO43-,二是水解平衡,HPO42-+H2O
H++PO43-,二是水解平衡,HPO42-+H2O H2PO4-+OH-,其水解程度大于电离程度,故溶液呈碱性
H2PO4-+OH-,其水解程度大于电离程度,故溶液呈碱性
(2)Na2HPO4溶液中存在电离平衡,HPO4- H++PO43-,加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性
H++PO43-,加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性
题空二 物质变化类简答题
1.结合物质的性质,推测产生结果的原因;叙述时一般可使用因果表述法。
![]() 例1
例1![]() 铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为_____________________________。
(2)在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。
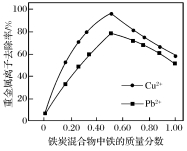
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是________________。
②当铁炭混合物中铁的质量分数大于 50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是___________________。
(3)纳米铁粉可用于处理地下水中的污染物。纳米铁粉除去水中NO3反应的离子方程式为4Fe+NO3-+10H+===4Fe2++NH4++3H2O,研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是________。
答案 (1)Cr2O72-+6e-+14H+===2Cr3++7H2O
(2)①活性炭对Cu2+和Pb2+有吸附作用
②铁的质量分数增加,铁炭混合物中微电池数目减少
(3)纳米铁粉与H+反应生成H2
2.推理判断理由的阐述
该类型简答题一般是依据题意,根据化学知识及相关的知识对题目所给的问题先进行分析判断,然后说明判断的理由。解题的思路:先对问题作出判断,得出结论,然后再由结论追溯到分析过程,最后再回到结论。采分点是推理过程和结论。
![]() 例2
例2![]() H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
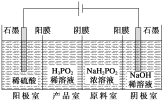
①写出阳极的电极反应式_________________。
②分析产品室可得到H3PO2的原因________________。
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替。并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有____________杂质。该杂质产生的原因是_______________________________。
[解题思路] ②

③

解析 ①阳极发生氧化反应,在反应中OH-失去电子,电极反应式为2H2O-4e-===O2↑+4H+。
②H2O放电产生H+,H+进入产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者发生反应:H++H2PO2-==H3PO2。
③如果撤去阳膜,H2PO2-或H3PO2可能被氧化。
答案 ①2H2O-4e-===O2↑+4H+ ②阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2穿过阴膜扩散至产品室,二者反应生成H3PO2 ③PO43- H2PO2-或H3PO2被氧化。

- 全部评论(0)
