化学反应原理型简答题突破套路
时间:2020-02-25 09:36 来源:未知 作者:化学自习室 点击: 次 所属专题: 化学反应原理简答题
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
微点1 速率、平衡移动类
【典例1】 在密闭容器中充入一定量H2S,发生反应2H2S(g)⇌2H2(g)+S2(g) ΔH=+169.8KJ·mol-1。下图为H2S气体的平衡转化率与温度、压强的关系。
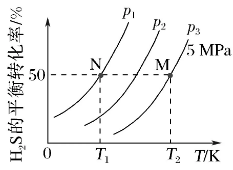
(1)图中压强(P1、P2、P3)的大小顺序为________,理由是_______。
(2)该反应平衡常数大小:K(T1)________(填“>”“<”或“=”)K(T2),理由是_________。
(3)如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有_________。
[解题思路]
答案(1)P1<P2<P3 该反应的正反应是气体分子数增大的反应,其他条件不变时,减小压强使平衡正向移动,H2S的平衡转化率增大,由图像上看,相同温度,P1条件下H2S的平衡转化率最大,P3条件下H2S的平衡转化率最小
(2)< 该反应正向是吸热反应,升高温度,平衡正向移动,平衡常数增大
(3)及时分离出产物
[解决方案] 速率、平衡移动类简答题的答题模板
叙特点(反应特点或容器特点)→变条件→定方向→得结论(或结果)
【对点训练1】(全国卷)煤燃烧排放的烟气含有SO2和NO,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
由实验结果可知,脱硫反应速率________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是_______________。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压P如图所示。
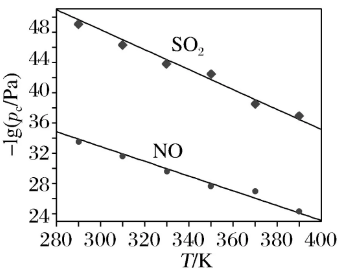
由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均________(填“增大”、“不变”或“减小”)。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是_____________。
答案 (1)大于 NO溶解度较低(或脱硝反应活化能较高)(2)减小 (3)形成硫酸钙沉淀,反应平衡向产物方向移动,SO2转化率提高
微点2 电解质溶液中离子平衡类
【典例2】Na2HPO4是磷酸的酸式盐,但其水溶液呈碱性,从溶液中离子平衡角度分析回答下列问题:
(1)解释Na2HPO4溶液呈碱性原因________________________。
(2)当加入足量饱和CaCl2溶液时,溶液变为酸性,解释原因_____________________。
[解题思路]
(1)
(2)
答案:(1)Na2HPO4溶液中存在两个平衡,一是电离平衡,HPO42-⇌H++PO43-,二是水解平衡,HPO42-+H2O⇌H2PO4-+OH-,其水解程度大于电离程度,故溶液呈碱性
(2)Na2HPO4溶液中存在电离平衡,HPO42⇌H++PO43-,加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使HPO的电离平衡向右移动,H+浓度增大,溶液显酸性
[解决方案] 溶液中离子平衡简答题思路
阅读题目情境的信息,找出核心问题的分析对象,即平衡体系;找出题目信息中与平衡体系变化的有关因素;利用平衡移动原理分析变化的因素对化学平衡移动的影响,即平衡移动方向的判断;说明平衡移动后对实际问题体系产生的影响。
一般用如下模式书写:“……存在……平衡,……(条件)使平衡向……(方向)移动,……(结论)”。
就是:平衡,移动,结论!三段式。
【对点训练2】25 ℃,H3AsO4电离常数为K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12。当溶液用生石灰调节pH到8~9时,沉淀主要成分为Ca3(AsO4)2。pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是____________________。
答案:H3AsO4是弱酸,电离出来的AsO43-较少,所以酸性条件下不易形成Ca3(AsO4)2沉淀,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀
微点3 能量变化类
【典例3】(全国卷)H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
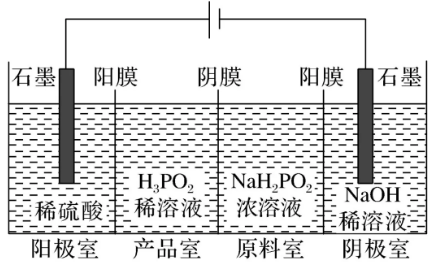
问题1:分析产品室可得到H3PO2的原因________________________。
问题2:早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替。并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质。该杂质产生的原因是_________________。
[解题思路]
问题1

问题2

答案 问题1:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO穿过阴膜扩散至产品室,二者反应生成H3PO2
问题2:H3PO4H2PO或H3PO2被氧化
【对点训练3】(北京卷)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:______________。
(2)当吸收液的pH降至约为6时,需送到电解槽再生。再生示意图如下:
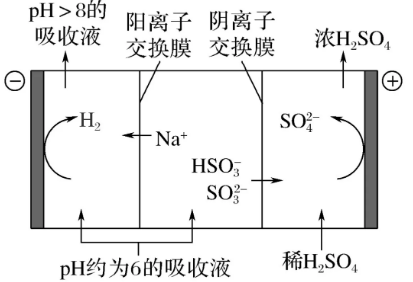
当阴极室中溶液pH升到8以上时,吸收液再生并循环利用。简述再生原理:_______________________________。
答案 (1)酸 NaHSO3溶液中的HSO3-存在两个平衡:HSO3-⇌H++SO32-和HSO3-+H2O⇌H2SO3+OH-,HSO3-的电离程度大于其水解程度
(2)H+在阴极得电子生成H2,溶液中c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生
【对点训练4】(全国卷)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
已知:2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g)ΔH=-1048.9 KJ·mol-1
问题:联氨和N2O4可作为火箭推进剂的主要原因为______________________。
答案 反应放热量大,产生大量的气体

- 全部评论(0)
