键角大小怎么比较?
时间:2020-06-09 18:03 来源:未知 作者:化学自习室 点击: 次 所属专题: 键角
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
学生疑问:
1、为什么NH3的键角是107°, NF3的键角是102.5°?
答题思考方向------- 配原子电负性对键角的影响, 相邻的两个成键电子对远离中心原子时、相互间的斥力会变小。
2、为什么NH3的键角是107°, PH3的键角是93.6°?
答题思考方向------中心原子电负性对键角的影响,成键电子对更靠近中心原子,成键电子对间的斥力要变大,
老师归纳:
影响分子中键角大小的因素
键角为某原子与另两个原子所成共价键间的夹角。
一、中心原子杂化类型对键角大小有决定性的影响
中心原子杂化类式是决定键角大小的最根本的原因。
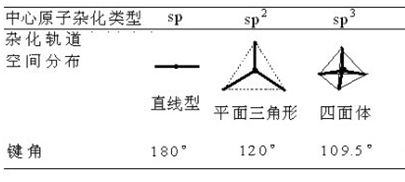
上表由前(左)到后(右)的顺序就基本是一个键角逐渐减小的顺序。
例1,对CH4、BF3、CO2这一分子序列,中心原子分别为sp3、sp2和sp杂化,它们对应的键角为109°28′、120°、180°,键角会依次增大。
二、中心原子孤电子对数目对键角的影响
由于中心原子的孤对电子的电子云肥大,对成键电子对有较大的排斥力,所以孤对电子能使成键电子对彼此离得更近,键角被压缩而变小。且中心原子的孤电子对数越多,键角会变得越小。
例2,对H2O、NH3、CH4分子系列。这3个分子的中心原子采取的都是sp3杂化,但孤电子对数不同。其孤电子对数分别为2、1、0.。在H2O分子中,键角要受2个孤电子对的压缩,键角应该会最小。这就导致出推断:该序列是一个键角逐渐增大的序列。可查得它们的键角分别是104.5°、107.1°、109.5°。
三、配原子电负性对键角的影响
当同一种原子中心原子种类相同、杂化类型也相同,而配原子种类不同时,由于配原子的电负性不同,会使键角有区别。因为当相邻的两个成键电子对更靠近中心原子时、相互间的斥力会增大。反之,当相邻的两个成键电子对远离近中心原子时、相互间的斥力会变小。
例3,将NF3与NH3比较,中心原子都是n(原子)、且都为sp3杂化,但因为F原子的电负性大于H原子,使成键电子离n(原子更远),两个N-F键间的斥力减小、可以靠的更近,所以其键角更小。实际上:NH3的键角是107°,NF3的键角是102.5°.
对常遇到的H2O与OF2分子的键角和极性比较,也可照上例来判断。
四、中心原子电负性对键角的影响
当同主族中心原子种类不同,但杂化类型相同、且配原子种类相同时,中心原子的电负性大,成键电子对更靠近中心原子,成键电子对间的斥力要变大,键角要变大。反之,中心原子电负性小的分子,成键电子对要远离中心原子,成键电子对间的斥力要变小,键角要变小。
例5,比较典型的例子是H2O与H2S的键角。通常认为其中的O与S原子都采取了sp3杂化,都有2个孤电子对。但O原子的电负性大,键角应该H2O比H2S中的键角大。又例如:PH3的键角是96.3°,NH3键角是107°
五、单键与重键对键角的影响不同
在同一个分子中,与单键相比较重键的成键电子数目要多一些,对另一单键电子对的斥力也要更大些。重键的存在,可使其相邻的由单键组成的键角变小。
例6,在COCl2分子中,C原子为sp2杂化。虽然等性sp2杂化的键角是120°。但由于C原子与O原子间以双键C=O结合,该双键对C-Cl键的斥力要更大些。所以。∠O-C-Cl键角要大于∠Cl-C-Cl键角
六、孤电子与孤电子对对键角的影响不同
奇分子(有成单电子的分子)是很少遇到,但有可能遇到的一种特殊的分子。由于奇分子的中心原子有一成单的孤电子,与组成和它基本相同、只是比它多一个电子的物种来比较,成单电子对成键电子的排斥力应该是小于孤电子对-成键电子对间的排斥力的。
例7.比较NO2+、NO2、NO2-物种中∠O-N-O键角的大小。可以采用如下的表格来帮助我们的分析。

也就是说有NO2+、NO2、NO2-的∠O-N-O键角依次减小的顺序。实测数据也证明了这一点。但令人意外的是:NO2的键角不但不比120°小一些,还比120°大了许多。
例2, NH3、 NH2OH、 NH2(CH3)、 NHF2、 NF3、 NF2(CH3),
键角 107.1°、 107°、 105.9°、 102.9°、102.4°、 101°
在这一系列NX3分子中,N原子均为sp3杂化,N原子都是以共价结合了3个原子(或原子团),都有一个孤电子对。它们的∠X-N-X键角都接近109.5°,并均略小于该数值。(以上N原子均为不等性sp3杂化。)
对相邻电子对间斥力大小的比较:孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对>成单孤电子-成键电子对”。
七、配体体积对键角的影响
当配体基团的体积较大时,基团电子云占据的空间也会相应增大,对相邻的键也会有很强的排斥作用。如上面的例3中的NH3、NH2OH、NH2(CH3),∠H-N-H键角依次减小。而对NF3与NF2(CH3),也是后者的∠F-N-F键角更小。这似乎说明体积更大些的(CH3)的排斥成键电子对的能力要强于(OH)、更强于H原子;说明(CH3)的排斥成键电子对的能力甚至于要强于F原子。
八、比较键角大小的思考程序:(高中阶段)
一看中心原子杂化类型,
二看中心原子的孤电子对数,
三看中心原子的电负性大小。

- 全部评论(0)
(3364755641) 评论 href="/plus/view.php?aid=18616">键角大小怎么比较?:总结得很好啊,我就一直不懂那个孤电子对对这个影响。辛苦老
(1146422112) 评论 href="/plus/view.php?aid=18616">键角大小怎么比较?:,,,,,,,,,
