无机综合(工艺流程)中的计算
时间:2020-12-22 11:27 来源:未知 作者:化学自习室 点击: 次 所属专题: 工艺流程计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
【突破方案】
1.三大守恒思想

2.电子守恒解题的思维模板

【常见类型及方法总结】
类型 | 解题方法 |
热重曲线计算 | ①设晶体为1 mol。②失重一般是先失水、再失非金属氧化物。③计算每步的m余, |
多步滴定计算 | 复杂的滴定可分为两类: ①连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的量 ②返滴定法:第一步用的滴定剂是过量的,然后第二步再用另一物质返滴定计算出过量的物质。根据第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量 |
电化学计算 | 根据得失电子守恒关系建立起已知量与未知量之间的桥梁,构建计算所需的关系式。 如以通过4 mol e-为桥梁可构建如下关系式:
(式中M为金属,n为其离子的化合价数值) |
根据溶度积常数 进行计算 | 1.表达式 (1)溶度积Ksp(AmBn)=cm(An+)·cn(Bm-),式中的浓度都是平衡浓度 (2)离子积Qc(AmBn)=cm(An+)·cn(Bm-),式中的浓度都是任意浓度 判断在一定条件下沉淀能否生成或溶解 2.应用 ①Qc>Ksp:溶液过饱和,有沉淀析出 ②Qc=Ksp:溶液饱和,处于平衡状态 ③Qc<Ksp:溶液未饱和,无沉淀析出 |
【即时训练】
【训练1】 草酸钴是制备钴氧化物的重要原料。下图为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。
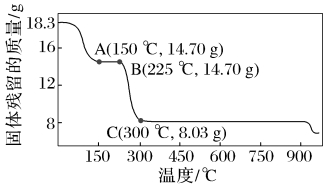
(1)通过计算确定C点剩余固体的成分为▲ (填化学式)。试写出b点对应的物质与O2在225~300 ℃条件下发生反应的化学方程式:▲ 。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3价),用480 mL 5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比(写出计算过程)▲ 。
答案:(1)Co3O4。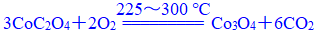
(2)由得失电子守恒有n(Co3+)=2n(Cl2)=2×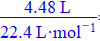 =0.4 mol,
=0.4 mol,
由电荷守恒有n(Co)总=n(Co2+)溶液=0.5n(Cl-)=0.5×(0.480×5-0.2×2) mol=1 mol,
所以固体中n(Co2+)=1 mol-0.4 mol=0.6 mol,
n(O)=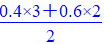 mol=1.2 mol,
mol=1.2 mol,
故n(Co)∶n(O)=1∶1.2=5∶6
【训练2】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
回答下列问题:
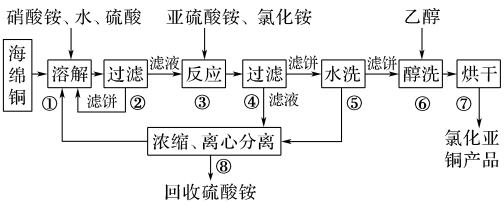
准确称取所制备的氯化亚铜样品 m g,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液b mL,反应中Cr2O72-被还原为Cr3+。样品中CuCl的质量分数为▲ 。
答案:
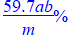
【训练3】 (工艺流程图略)硼氢化物NaBH4(B元素的化合价为+3价)燃料电池,其工作原理如图所示,放电时,每转移2 mol 电子,理论上需要消耗▲ g NaBH4。
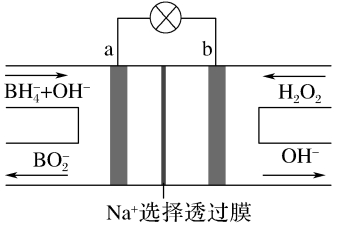
解析 负极发生氧化反应生成BO2-,电极反应式为BH4-+8OH--8e-===BO2-+6H2O,每转移2 mol 电子,理论上需要消耗0.25 mol 即9.5 g NaBH4。

- 全部评论(0)