质子守恒三种思维模型
时间:2021-01-19 16:22 来源:未知 作者:化学自习室 点击: 次 所属专题: 质子守恒
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
所谓质子守恒式的本质,是指在水溶液中,酸碱盐组分离子(包括水分子),在电离和离子反应过程中,可能会发生质子转移,也就是H+的转移。这样,必有一方为质子接受体,一方为质子给予体,而质子给予体提供的质子总数等于质子接受体接受的质子总数。这便是质子守恒式子的书写依据。
书写质子守恒式,一般有质子守恒式原始式和推演式。前者是式中出现的每一种离子都发生了质子的转移;后一类是质子守恒式基础上的衍生式,它对原始式的加工——或者出现了其他不参与质子转移的离子,或消去了部分离子。我们这里只讨论质子守恒式的原始式。
1、质子守恒方法梳理
当前质子守恒书写方式方法丰富多样,根据采用的形式不同,一般分为三大类:代数法,框图法,数轴法。
1.1代数法
代数法,又称为代数推演法,这是最基本的方法,大家都非常熟悉——就是由电荷守恒和物料守恒,进行代数运算,消去不参与质子转移的无关离子,进而推出质子守恒式。广泛应用在单一组分溶液质子守恒式的书写中,但当书写双组分时,代数法运算量骤然变大,运算出错概率也随之增大,此时代数法较之肯定是处于劣势。
1.2框图法
框图法,通过框图表现形式,使一侧为质子给予体,一侧为质子接受体。单组分溶液利用框图法直观简便。当分析对象为双组分溶液时,根据分析思路不同,分成两种不同方法。
一种是组分统筹法,是把混合溶液看成统一整体来分析。一些文献上称为框图分析法[1],这种思路中单一组分概念与单一溶液单一组分概念内涵不同,不再指一种具体微粒,而是指可以通过转移质子相互转化的一类微粒,比如CO32-、HCO3-、H2CO3,它们可以通过质子转移相互转化,便把它们看做一种组分;按此思路,那么不同组分即不能通过转移质子相互转化的微粒,比如NH4+与CO32-这两种离子无论如何质子转移都不会相互转化,便看做两种组分。
另一种为组分分离法,也可称之为校正法,是把混合溶液看成基础单一溶液加外来溶液,但是,这绝对不是单一组分质子守恒式的直接叠加。式子形式:[某一组分基础表达式-外加溶液原始浓度]
这两种方法本质相同,都可以通过数学运算相互转化,相比较而言组分分离法更能解决有强酸碱参与的混合溶液,组分统筹法更便于直观理解。
1.3数轴法
数轴法,是与框图法并列的方法,摒弃框图形式,借助一维数轴来体现质子转移。
接下来我们来用实例来探讨下这些方法。我们由简到难,单一溶液到双组分不同溶液。
2、实例分析
2.1单一溶液 a mol/L NH4HCO3溶液
2.1.1代数推演法:
电荷守恒:c(NH4+) + c(H+) = c(HCO3-) + 2c(CO32-) + c(OH-)
物料守恒:c(NH4+) + c(NH3·H2O) = c(HCO3-) + c(H2CO3) + c(CO32-)
质子守恒:c(H2CO3) + c(H+) = c(NH3·H2O) + c(CO32-) + c(OH-)
2.1.2框图法:
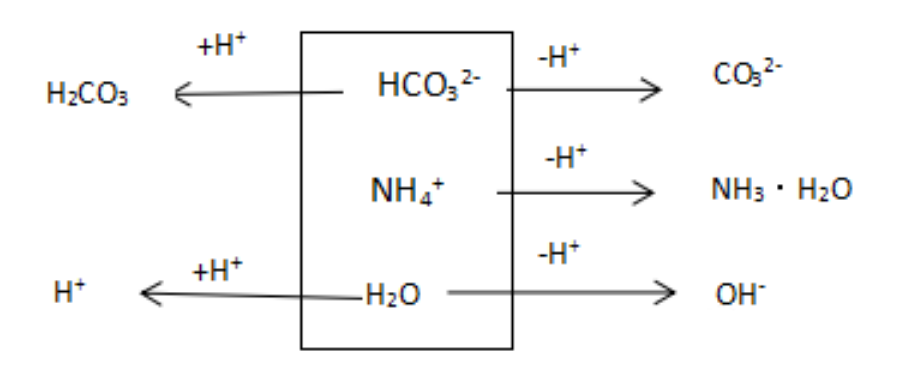
图1:a mol/L NH4HCO3溶液分析框图
c(NH3·H2O) + c(CO32-) + c(OH-) = c(H2CO3) + c(H+)
2.1.3数轴解析法:
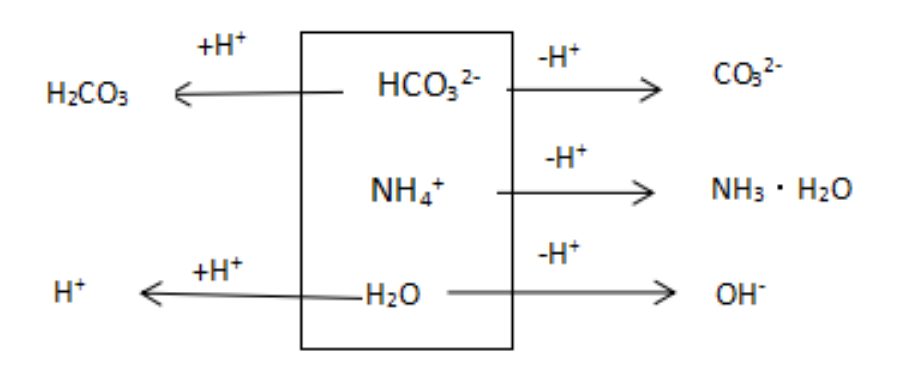
图2:a mol/L NH4HCO3溶液分析数轴
c(NH3·H2O) + c(CO32-) + c(OH-) = c(H2CO3) + c(H+)
2.2不同浓度双组分溶液:a mol/L(NH4)2CO3与b mol/L NH4HCO3溶液
2.2.1代数推演法
电荷守恒式:c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)………………………①
物料守恒式:(a+b)×[c(NH4+)+c(NH3·H2O)] = (2a+b)×[c(H2CO3) + c(HCO3-)+c(CO32-)]…②
由①②合并,消去c(NH4+),得:
(2a+b)× c(H2CO3) + a×c(HCO3-)+(a+b)×c(H+)=(a+b) ×c(NH3·H2O) + b×c(CO32-)+ (a+b)× c(OH-)
2.2.2框图法:
(1)组分分离法一:
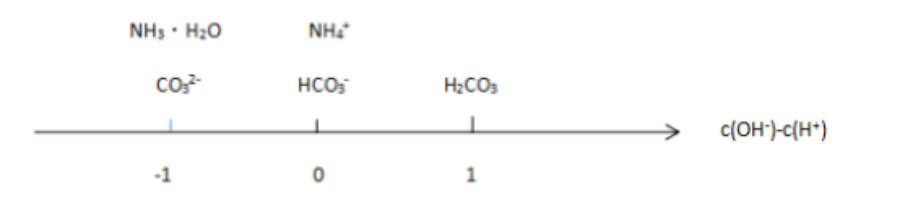
图3:a mol/L(NH4)2CO3分析框图
a×c(HCO3-) + 2a×c(H2CO3) + a×c(H+) = 2a×c(NH3·H2O) + a×c(OH-)……①
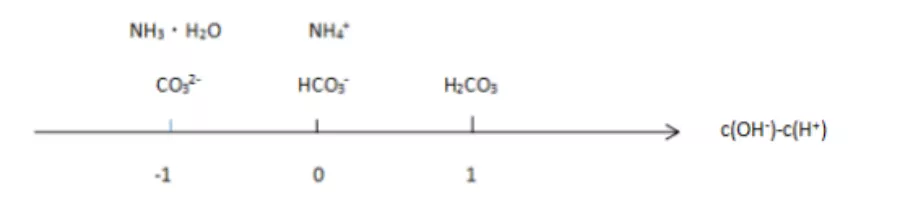
图4:b mol/L NH4HCO3溶液分析框图
c(H2CO3)+b×c(H+)=b× C(CO32-) + b× c(NH3·H2O) + b× c(OH-)……②
合并①②得:(2a+b)×c(H2CO3) + a×c(HCO3-) + (a+b)× c(H+) = (a+b)× c(NH3·H2O) + (a+b)× c(OH-)+ b× c(CO32-)
(2)组分分离法二:
c(NH3·H2O) + c(OH-) = c(HCO3-) + 2c(H2CO3) + c(H+) -b/(a+b)× [C(CO32-) + c(HCO3-) + c(H2CO3)]
即:
(a+b)×c(NH3·H2O) + (a+b)×c(OH-) + b× c(CO32-) = a× c(HCO3-) + (a+b)× c(H+) + (2a+b)× c(H2CO3)
(3)组分分离法三:
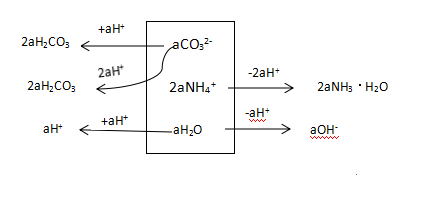
图5:a mol/L(NH4)2CO3分析框图
c(HCO3-) +2c(H2CO3) + c(H+) -b = c(OH-) +c(NH3·H2O)……………………①
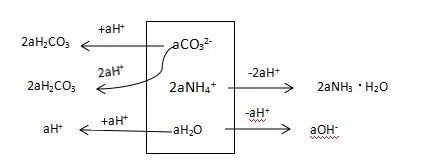
c(H2CO3) + c(H+) = c(OH-) + c(NH3·H2O) + c(CO32-) -a……………………②
①×a + ②×b 得:
(a+b)×c(H+) + a× c(HCO3-) + (2a+b)×c(H2CO3) = (a+b)×c(OH-) +(a+b)×c(NH3·H2O) + b×c(CO32-)
(4)框图统筹法:
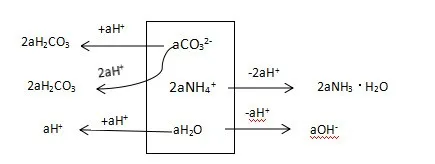
图7:a mol/L(NH4)2CO3 分析框图
a/(a+b)×c(HCO3-)+2a/(a+b)×c(H2CO3) +a/(a+b)× c(H+) = 2a/(2a+b)×c(NH3·H2O) +a/(a+b)×c(OH-)
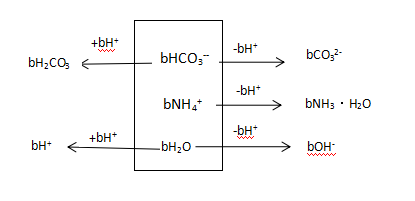
图8:b mol/L NH4HCO3溶液 分析框图
b/(a+b)×c(H2CO3) + b/(a+b)×c(H+) = b/(2a+b)×c(NH3·H2O) + b/(a+b)×c(OH-) +b/(a+b)×c(CO32-)
合并得:
(2a+b)×c(H2CO3) + a×c(HCO3-) +(a+b)×c(H+) = (a+b)×c(NH3·H2O) + (a+b)×c(OH-) + b×c(CO32-)
2.2.3数轴法
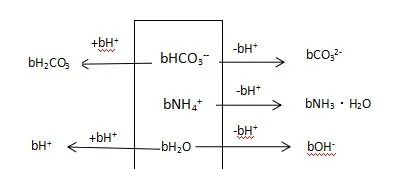
图9:a mol/L(NH4)2CO3与b mol/L NH4HCO3溶液分析数轴
c(OH-)-c(H+) = a/(a+b)×c(HCO3-) + (2a+b)/(a+b)×c(H2CO3) -b/(a+b)×c(CO32-) -c(NH3·H2O)
即:
(a+b)×c(OH-) + b×c(CO32-) + (a+b)×c(NH3·H2O) =(a+b)×c(H+) +a×c(HCO3-) +(2a+b)×c(H2CO3)

- 全部评论(0)
