突破高考化学水溶液中离子平衡的对数图像题
时间:2021-02-23 12:54 来源:未知 作者:化学自习室 点击: 次 所属专题: 对数曲线
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.对数图像的含义。
将溶液中某一微粒的浓度[如c(A)]或某些微粒浓度的比值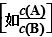 取常用对数,即lgc(A)或
取常用对数,即lgc(A)或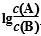 ,与溶液中的pH或溶液的体积等关系作出的图像称为对数图像。
,与溶液中的pH或溶液的体积等关系作出的图像称为对数图像。
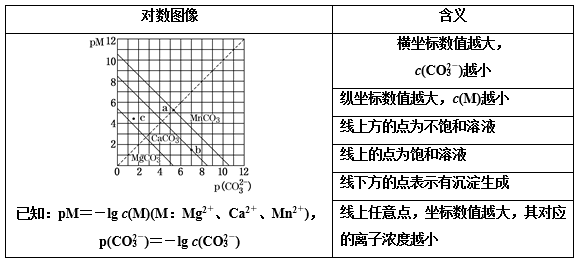
图像中数据的的含义为:
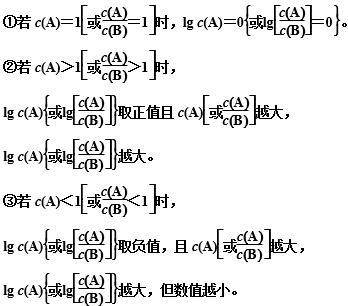
2.常考对数图像的类型
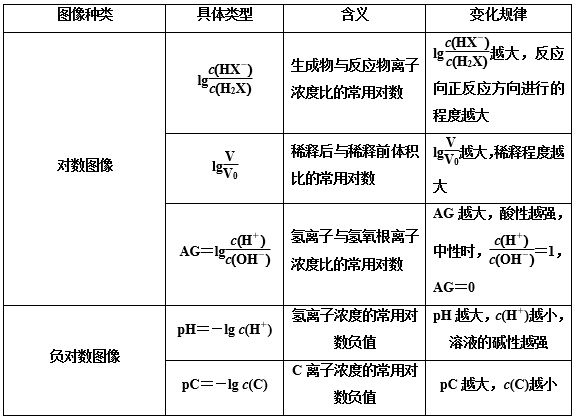
例如,有关沉淀溶解平衡的对数图像分析如下:
3.高考真题解析与启示
[例1](2018·全国卷Ⅲ)用0.100mol·L-1AgNO3滴定50.0mL 0.050 0 mol·L-1Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )
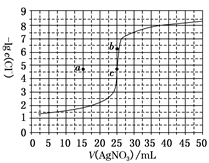
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.0400 mol·L-1Cl-,反应终点c移到a
D.相同实验条件下,若改为0.0500 mol·L-1Br-,反应终点c向b方向移动
[图解过程]
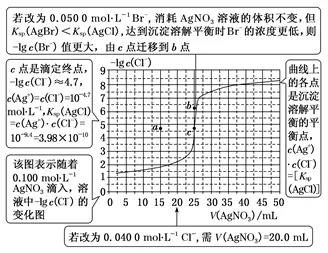
[解析] 根据Ag++Cl-==AgCl↓可知,达到滴定终点时,消耗AgNO3溶液的体积为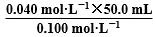 =20.0 mL,C项错误;由题图可知,当AgNO3溶液的体积为50.0 mL 时,溶液中的c(Cl-)略小于10-8mol·L-1,此时混合溶液中c(Ag+)=
=20.0 mL,C项错误;由题图可知,当AgNO3溶液的体积为50.0 mL 时,溶液中的c(Cl-)略小于10-8mol·L-1,此时混合溶液中c(Ag+)=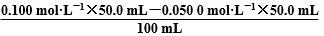 =2.5×10-2mol·L-1,故Ksp=c(Ag+)·c(Cl-)≈2.5×10-2×10-8=2.5×10-10,A项正确;因反应过程中有沉淀生成,溶液中必然存在平衡AgCl(s)
=2.5×10-2mol·L-1,故Ksp=c(Ag+)·c(Cl-)≈2.5×10-2×10-8=2.5×10-10,A项正确;因反应过程中有沉淀生成,溶液中必然存在平衡AgCl(s) Ag+(aq)+Cl-(aq),故曲线上的各点均满足c(Ag+)·c(Cl-)=Ksp(AgCl),B项正确;根据Ag++Cl-===AgCl↓可知,达到滴定终点时,消耗AgNO3溶液的体积为
Ag+(aq)+Cl-(aq),故曲线上的各点均满足c(Ag+)·c(Cl-)=Ksp(AgCl),B项正确;根据Ag++Cl-===AgCl↓可知,达到滴定终点时,消耗AgNO3溶液的体积为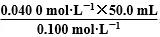 =20.0 mL,C项错误;相同实验条件下,沉淀相同量的Cl-和Br-消耗的AgNO3的量相同,由于Ksp(AgBr)<Ksp(AgCl),当滴加相等量的Ag+时,溶液中c(Br-)<c(Cl-),故反应终点c向b方向移动,D项正确。
=20.0 mL,C项错误;相同实验条件下,沉淀相同量的Cl-和Br-消耗的AgNO3的量相同,由于Ksp(AgBr)<Ksp(AgCl),当滴加相等量的Ag+时,溶液中c(Br-)<c(Cl-),故反应终点c向b方向移动,D项正确。
[答案]C
[例2](2017·全国卷Ⅰ)常温下,将NaOH溶液滴加到己二酸(H2X)混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是()
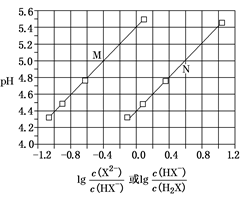
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lg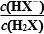 的变化关系
的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
[图解过程]
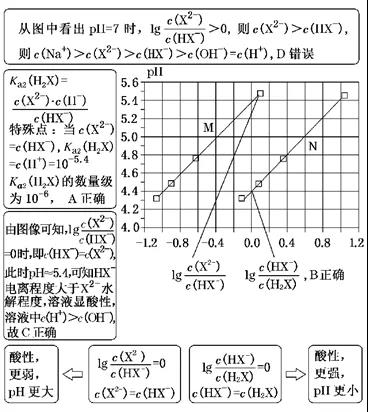
[答案]D
4.对数图像的解题策略
①先确定图像的类型是对数图像还是负对数图像。
②再弄清楚图像中横坐标和纵坐标的含义,是浓度对数还是比值对数。
③抓住图像中特殊点:如pH=7、lg x=0,交叉点。
如例2中的横坐标为0的点是指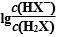 =0。此时c(HX-)=c(H2X),此时pH=4.4,进而求得Ka1=10-4.4。
=0。此时c(HX-)=c(H2X),此时pH=4.4,进而求得Ka1=10-4.4。
④理清图像中曲线的变化趋势及含义,根据含义判断线上、线下的点所表示的意义。
⑤将图像中数据或曲线的变化与所学知识对接,作出选项的正误判断。

- 全部评论(0)
