难点十二:离域π键原子确定与类型推理
时间:2021-04-15 10:33 来源:高中化学教学研究 作者:张德金 点击: 次 所属专题: 大Π键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、学习离域π键的知识准备:
(1)会用路易斯理论推理并书写简单的共价化合物或带共价键的离子的电子式。如HCN、NaCN的电子式。
(2)会用VSEPR理论推理分子或离子的空间构型。因为需要用这个理论推理分子或离子是否为平面结构。
2、原子能参与形成离域π键的条件。(不考虑利用d轨道形成离域π键)
(1)原子本身有π键。
(2)原子若无π键,则需要有孤电子对或P能级的空轨道。在孤电子对中,电子数可以是2个或1个电子。
(3)原子处于几个原子所在的平面中。
3、离域π键类型的分析过程
如果已经知道某分子或离子有离域π键,则类型的分析过程如下
(1)用单键画出分子或离子的结构图
(2)在参与形成离域π键的原子上标上竖直箭头,表示它有一个离域π键。
(3)根据路易斯理论画出参与形成离域π键的原子的孤电子对。
周围原子的孤电子对数=4-1-共价键数(1表示离域π键,共价键数包括σ键数和π键数)
中心原子有时可以不满足路易斯理论中的八电子稳定。
(4)计算参与形成离域π键的原子的剩余电子数,写在(2)的箭头上方。剩余电子数=价电子数-共价键数-孤电子对中含有的电子数。
(5)若计算出的剩余电子数超过2,则在此原子与相连原子之间增加一个键。重新计算孤电子对数和剩余电子数。
(6)得到离域π键的类型。
例一,下面是NO3-的离域π键推理图示:
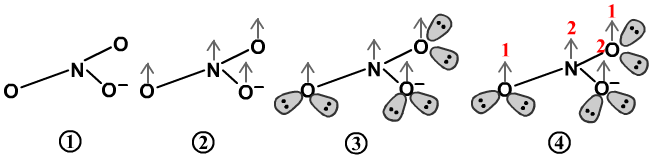
①画出NO3-的单键结构图,注意它是离子,有一个O得到1个电子显示-1价,这个O的最外层有7个电子,其它的O的最外层是6个电子。
②每个原子上加上箭头,表示它上面有1个离域π键。
③在每个原子上加上孤电子对。对于O,已经有1个σ键和1个离域π键,而且O只需要形成两个键即可,所以O上另外可以形成两对孤电子对。
N的周围已经有3个σ键和1个离域π键,不需要再形成孤电子对。
④计算每一个原子的剩余电子,写在箭头上方。
⑤NO3-的离域π键为П46型。
例二,下而是叠氮酸的推理图示:

①画出HN3的单键结构图。
②在每个N原子上加上箭头,表示它上面有1个离域π键。
③推理发现,若以单键推理,中间N箭头上的剩余电子数为3。需要在后两个N之间增加1个键。
④在每个N原子上加上孤电子对。
⑤计算每一个原子的剩余电子,写在箭头上方。
⑥HN3的离域π键为П34型。
3、如果不确定哪些原子参与了离域π键的形成,先用VSEPR理论推理出一些原子是否在同一平面,并且确定原子周围是否有π键、孤电子对或空轨道。
例如下面的阳离子中
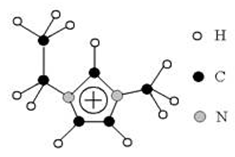
所有的H不在离域π键中,因为H没有p轨道。
左上角的两个C和最右侧的C也不在离域π键中,因为它们周围既没有π键,也没有孤电子对和空的p轨道。
下面的两个C之间有π键,可以在离域π键中。
中间的两个N有孤电子对,可以在离域π键中。
上面中间的C失去了一个电子,只有三个价电子,且已经形成了三对共用电子,它有一个空的p轨道,可以在离域π键中。
上面中间的C形成了四点共面的平面。下面的两个C形成了烯的六点共面。两个N在这两个平面中。若两平面重合,形成更大的平面,就可以形成更大的离域π键。
最后推理得,上面的分子的离域π键的类型为П56型。
4、有些离子或分子没有离域π键。
像PCl5的分子结构为六面体结构,SF6的分子结构为八面体结构,它们都没有离域π键。
PO43-、SO32-、SO42-等,都不是平面结构,也没有离域π键。
5、对于直线型分子,可以形成2个离域π键。
像CO2,可以利用三个原子的平行Py轨道形成离域π键,也可以利用三个原子的平行pz轨道形成离域π键。所以CO2的离域π键有两个,均为П34型。
【练习】
1、写出下列分子或离子的离域π键类型:
(1)SO2;NO2-。
(2)O3;CO32-。
(3)N2O;BF3。
2、判断ClO3-、ClO4-有没有离域π键?
【练习答案】
1、(1)П34;П34。
(2)П34;П46。
(3)两个П34;П46。
2、都没有。

- 全部评论(0)
