例析大π键中电子数计算方法
时间:2025-01-06 11:52 来源:未知 作者:化学自习室 点击: 次 所属专题: 大π键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、概念
在多原子分子(就是三个或三个以上的原子构成的分子)中,如有相互平行的P轨道, 它们连贯地“肩并肩”地重叠在一起构成一个整体,P电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键或共轭大π键,或者简简单单就叫大π键。这种在化合物分子或离子中的π键电子在参加成键的多个原子形成的分子或离子骨架中运动。
那么两个原子能不能形成大π键呢?一般而言,会直接认为就是形成了π键(不离域),因为就是两者提供的P-P电子云肩并肩形成的,即使电子由一方提供,如CO。

一氧化碳共用的第三对电子由氧原子提供(图源:网络)
二、形成和性质
1、形成
(1)所有参与形成离域π键的原子在同一平面上,因此中心原子采取sp2杂化或sp杂化
(2)参与形成离域π键的原子都必须提供一个或两个相互平行的P轨道(这些P轨道会垂直这个平面)
(3)形成离域π键的P轨道上的电子总数小于P轨道数的2倍(就是没有填满P轨道)
2、性质
3、表示方法
πnm ,n为参与提供大π键的平行P轨道(一般粒子有几个原子,就是几个P轨道),所以大多数情况下,n就是参与的原子个数,m为共用电子个数,m≤2n
如:π34指平行于P轨道的数目有3个(即原子数),平行P轨道里的电子数为4。
4、获得m和n的方法
πnm ,怎么表达 ,就是能准确说出几个原子提供了多少电子,形成了大π键。
我们可以通过计算获得n和m。
(1)ABx型的分子或离子
【电子式计算法】πnm
①n为原子个数):一般粒子有几个原子,就是可以提供几个P轨道,如:SO2有3个原子形成π键,则N=3
②m值的计算
A.分析出参与形成离域π键的每个原子形成几个σ键
B.形成σ键后,若原子中有一个成单电子,则该电子参与形成大π键,若没有成单电子,则最多提供有一对孤对电子参与形成大π键(指的是即使有两对孤电子对,也只能提供一对参与大π键的成键)
物质 | 分析方法 | 大π键 |
SO2 | S、O原子的电子式分别为: | π34 |
O3 | O原子的电子式为: | π34 |
NO2- |
| π34 |
CO2 | C、O原子的电子式分别为: | π34 |
CO32- | C、O原子的电子式分别为: | π46 |
这些微粒的大π键图形可以表达为:
CO2:

O3:
CO32-:

【价电子数计算法】πnm
①n为原子个数:与电子式算法相同,粒子有几个原子,就是几个P轨道,如:SO2有3个原子形成π键,则n=3
②m值的计算(是3个部分加起来的总和)
A.中心原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数(不参与成键,前差值<4为0,≥4为2)
B.成键原子=成键后单电子数总和
C.外界:阴阳离子,遵循“阴+阳-”
物质 | 分析方法 | 大π键 |
SO2 | ①S的杂化:sp2 ②形成大π键的p轨道电子总数 A.中心S原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数= 6-2×1-2= 2 B.成键原子=2×1= 2 C.外界:0 m=2+2= 4,因此SO2大π键为π34 | π34 |
| ①N的杂化:sp ②形成大π键的P轨道电子总数 A.中心N原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数= 5-2×1-0 = 3 B.成键原子=2×1= 2 C.外界:-1 m=3+2-1= 4,因此NO2+大π键为π34 | π34 |
SO3 | ①S的杂化:sp2 ②形成大π键的P轨道电子总数 A.中心S原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数= 6-3×1-0= 3 B.成键原子=3×1= 3 C.外界:0 m=3+3 = 6,因此SO3大π键为π46 | π46 |
| ①N的杂化:sp2 ②形成大π键的P轨道电子总数 A.中心N原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数= 5-3×1-0= 2 B.成键原子=3×1= 3 C.外界:1 m=2+3+1= 6,因此NO3-大π键为π46 | π46 |
(2)多个中心原子(ABy)型的分子或离子(用方法一)
环状物分子均为sp2杂化,链状物也必须为sp2杂化或sp杂化。
①n即为原子个数x
②m值的计算
A.分析参与形成离域π键的每个原子形成几个σ键
B.形成σ键后,若只有一个成单电子,则该电子参与形成大π键,若没有成单电子,则最多有一对孤对电子参与形成大π键
物质 | 分析方法 | 大π键 |
苯:
| C原子的电子式为: | π66 |
吡啶:
| C、N原子的电子式为: | π66 |
吡咯:
| C、n(原子的电子式为): | π56 |
吡唑:
| C、N原子的电子式为: | π56 |
呋喃:
| C、O原子的电子式为: | π56 |
噻吩:
| C、S原子的电子式为: | π56 |
| C、Se原子的电子式为: | π56 |
若链状的 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,所以m=4×1=4,因此其大π键为π44, 则下列这些环状分子的大π键是怎么表示的呢?
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,所以m=4×1=4,因此其大π键为π44, 则下列这些环状分子的大π键是怎么表示的呢?

答案:咪唑:π56 ,噻唑:π56,
解析:噻唑比𫫇唑拥有一个更大的π电子离域化,所以也更具有芳香性。这个理论被环上氢原子的核磁共振所证明(核磁共振数据介于7.27到8.77之间),体现了一个很强的反磁性环电流。
根据对环上π电子密度的计算,C5是最强的亲电位点,C2是亲核位点。

噁唑:π56,异噁唑:π56

- 全部评论(0)
 、
、 ,中心原子S采取sp2杂化,形成2个σ键后,还余下4个电子即2对孤对电子,S原子最多提供1对孤对电子形成大π键;O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子分别提供单电子参与形成大π键,故m=2+2×1= 4,因此SO2大π键为
,中心原子S采取sp2杂化,形成2个σ键后,还余下4个电子即2对孤对电子,S原子最多提供1对孤对电子形成大π键;O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子分别提供单电子参与形成大π键,故m=2+2×1= 4,因此SO2大π键为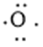 ,中心O原子采取sp2杂化,形成2个σ键,还有4个电子即2对孤对电子,中心O原子最多提供1对孤对电子形成大π键;与其成键的两个O原子形成1个σ键后,还分别有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,故m=2+2×1= 4,因此O3大π键为
,中心O原子采取sp2杂化,形成2个σ键,还有4个电子即2对孤对电子,中心O原子最多提供1对孤对电子形成大π键;与其成键的两个O原子形成1个σ键后,还分别有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,故m=2+2×1= 4,因此O3大π键为
 、
、 、
、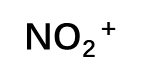

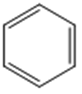
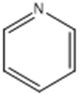
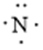 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键;N原子形成2个σ键,余3个电子,有一个成单电子参与形成大π键,所以m=5×1+1= 6,因此其大π键为
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键;N原子形成2个σ键,余3个电子,有一个成单电子参与形成大π键,所以m=5×1+1= 6,因此其大π键为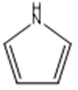


 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,O原子形成2个σ键,还有4个电子即2对孤对电子,O原子最多只能提供1对孤对电子形成大π键,所以m=4×1+2=6,因此其大π键为
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,O原子形成2个σ键,还有4个电子即2对孤对电子,O原子最多只能提供1对孤对电子形成大π键,所以m=4×1+2=6,因此其大π键为
 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,参与形成大π键;S原子形成2个σ键,还有4个电子即2对孤对电子,S原子最多只能提供1对孤对电子形成大π键,所以m=4×1+2= 6,因此其大π键为
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,参与形成大π键;S原子形成2个σ键,还有4个电子即2对孤对电子,S原子最多只能提供1对孤对电子形成大π键,所以m=4×1+2= 6,因此其大π键为
 ,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,参与形成大π键;Se原子形成2个σ键,还有4个电子即2对孤对电子,Se原子最多提供1对孤对电子形成大π键,所以m=4×1+2= 6,因此其大π键为
,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,参与形成大π键;Se原子形成2个σ键,还有4个电子即2对孤对电子,Se原子最多提供1对孤对电子形成大π键,所以m=4×1+2= 6,因此其大π键为